Ανδρέας Ιωάννου Κασσέτας

A mathematician may say
anything he pleases,
but a physicist must be at
least partially sane.
Josiah Willard GIBBS
Η ΦΥΣΙΚΟΧΗΜΕΙΑ έχει τον δικό της πατριάρχη.
Έναν Αμερικανό από το Κονέκτικατ
Tον
19ο αιώνα η Αμερικανική Δημοκρατία διέθετε ελάχιστους μεγάλους
φυσικούς, ανάμεσά στους οποίους ξεχώριζε ο Joseph Henry, αλλά για πολλούς λόγους οι επίλεκτοι αυτοί
φυσικοί προτιμούσαν να ασχολούνται με πειραματική μόνο έρευνα και με θέματα
τεχνολογίας. Η εμφάνιση του Τζόσια
Γουίλαρντ Γκιμπς αποτέλεσε την πρώτη εξαίρεση. Το έργο του, απλωμένο στη
Θερμοδυναμική, στη Χημεία και στη Στατιστική Μηχανική, ήταν καθαρά θεωρητικό.
Εξάλλου η παρουσία του σηματοδοτεί και την «είσοδο» των Ηνωμένων Πολιτειών στη
Θεωρητική Φυσική
Γεννημένος
στο Νιου Χέηβεν του Κονέκτικατ την ίδια περίπου εποχή που στην Ολλανδία  γεννιόταν ο Van der Waals, λίγο μικρότερος από τον
Σκοτσέζο Maxwell και λίγο μεγαλύτερος από τον Αυστριακό Boltzmann , o Josiah Willard GIBBS υπήρξε ο άνθρωπος που θεμελίωσε την Φυσικοχημεία
και τη Χημική Θερμοδυναμική και τη Στατιστική Μηχναική . Αλλά και στο πεδίο των
«καθαρών» μαθηματικών ήταν αυτός που ανακάλυψε τη Διανυσματική Ανάλυση,
ανεξάρτητα από τον Άγγλο Oliver Heaviside.
γεννιόταν ο Van der Waals, λίγο μικρότερος από τον
Σκοτσέζο Maxwell και λίγο μεγαλύτερος από τον Αυστριακό Boltzmann , o Josiah Willard GIBBS υπήρξε ο άνθρωπος που θεμελίωσε την Φυσικοχημεία
και τη Χημική Θερμοδυναμική και τη Στατιστική Μηχναική . Αλλά και στο πεδίο των
«καθαρών» μαθηματικών ήταν αυτός που ανακάλυψε τη Διανυσματική Ανάλυση,
ανεξάρτητα από τον Άγγλο Oliver Heaviside.
Άνθρωπος μοναχικός, προτιμούσε να δημοσιεύει
σημαντικές εργασίες του σε  έντυπα
περιορισμένης αποδοχής, όπως το περιοδικό του Πανεπιστημίου του
Κονέκτικατ, με αποτέλεσμα το έργο του να
καθυστερήσει να αναγνωριστεί μολονότι αρκετά έγκαιρα ο Ostwald είχε
φροντίσει να μεταφράσει ένα βασικό βιβλίο του στα γερμανικά .
έντυπα
περιορισμένης αποδοχής, όπως το περιοδικό του Πανεπιστημίου του
Κονέκτικατ, με αποτέλεσμα το έργο του να
καθυστερήσει να αναγνωριστεί μολονότι αρκετά έγκαιρα ο Ostwald είχε
φροντίσει να μεταφράσει ένα βασικό βιβλίο του στα γερμανικά .
 Μόνο
το 1901, δύο χρόνια πριν από τον θάνατό του,η Royal Society του Λονδίνου του απένειμε το μετάλλιο Copley, τη
μεγαλύτερη δυνατή διάκριση της εποχής του, τιμώντας τον διότι υπήρξε ο πρώτος
θεωρητικός που εφάρμοσε τον Δεύτερο νόμο της Θερμοδυναμικής αναζητώντας μια
σχέση ανάμεσα στη χημική ενέργεια, στη θερμική ενέργεια και στο έργο.
Μόνο
το 1901, δύο χρόνια πριν από τον θάνατό του,η Royal Society του Λονδίνου του απένειμε το μετάλλιο Copley, τη
μεγαλύτερη δυνατή διάκριση της εποχής του, τιμώντας τον διότι υπήρξε ο πρώτος
θεωρητικός που εφάρμοσε τον Δεύτερο νόμο της Θερμοδυναμικής αναζητώντας μια
σχέση ανάμεσα στη χημική ενέργεια, στη θερμική ενέργεια και στο έργο.
Σήμερα αναγνωρίζεται – και όχι μόνο από τους
Αμερικανούς - ως ο πρωτοπόρος της Φυσικοχημείας.
Κατά τη δεκαετία του 1890 επεξεργάστηκε μια μέθοδο
Στατιστικής Μηχανικής η οποία μπορούσε να εφαρμοστεί και στις τρεις καταστάσεις
της ύλης. Στην αυγή του 20ου αιώνα παρουσίασε το βιβλίο Elementary Principles of Statistical Mechnics.
Θεωρείται ότι με το σύνολο του έργου του
εμπλούτισε την επιστήμη με ένα «δυνατό κοκτέιλ» Φυσικής, Χημείας και
Μαθηματικών.
Η έννοια ΕΛΕΥΘΕΡΗ ΕΝΕΡΓΕΙΑ GIBBS .
Η έννοια έκανε την εμφάνισή
της ως available energy ή free energy το 1870 σε
γραπτό του τριαντάχρονου τότε Willard GIBBS. Σήμερα λέγεται «ΕΛΕΥΘΕΡΗ
ΕΝΕΡΓΕΙΑ GIBBS»
Η
τιμή της μας δίνει απάντηση στο ερώτημα « ποιο δρόμο θα ακολουθήσει μια χημική
αντίδραση σε ένα δεδομένο πλαίσιο συνθηκών;» . Ούτε η ΕΝΘΑΛΠΙΑ ούτε η εντροπική
ενέργεια -το
γινόμενο TS «εντροπία επί θερμοκρασία» - μπορεί να μας δώσει μια απάντηση. Την δίνει η ελεύθερη ενέργεια Gibbs
η τιμή G της
οποίας ορίζεται με τη σχέση G
= U + PV - TS
Αν
μάλιστα θυμηθούμε ότι η ενθαλπία Η είναι H = U + PV μπορούμε να δούμε ότι ο G
= H - TS η
ελεύθερη ενέργεια GIBBS είναι η διαφορά ενθαλπίας και εντροπικής
ενέργειας.

.
Αν
διαφορίσουμε τη σχέση
G
= U
+ PV
- TS
παίρνουμε
dG = dU + PdV + VdP -
TdS - SdT
Βάσει του ορισμού της εντροπίας το γινόμενο TdS είναι στοιχειώδης ποσότητα θερμότητας
ενώ PdV είναι το στοιχειώδες έργο και
λόγω του πρώτου νόμου της θερμοδυναμικής
TdS = dU + PdV, οπότε η προηγούμενη σχέση
οδηγεί στην dG = VdP - SdT
η οποία
εκφράζει ότι οι μεταβολές της ΕΛΕΥΘΕΡΗΣ ΕΝΕΡΓΕΙΑΣ προέρχονται
από μεταβολές πίεσης και θερμοκρασίας
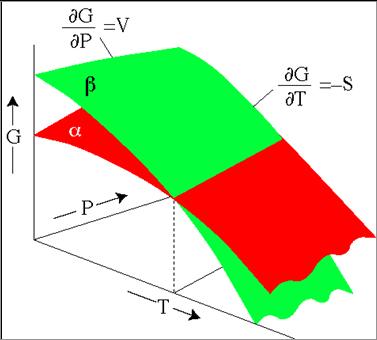
Μπορούμε επίσης να συμπεράνουμε ότι η ως προς την πίεση μερική παράγωγος της ελεύθερης ενέργειας είναι ίση με τον όγκο ενώ η ως προς τι θερμοκρασία μερική παράγωγος είναι το αντίθετο της ενθαλπίας
∂G/∂Ρ = V
∂G/∂T = -S
..