![]()
Η χημική ισορροπία για ένα ασθενές μονοπρωτικό οξύ περιγράφεται με την παρακάτω αντίδραση:
![]()
Αν
στο διάλυμα αυτό προστεθεί οξύ τότε αυξάνεται η συγκέντρωση των Η3Ο+.
Όμως σύμφωνα με την αρχή του
Le
Chatelier και Van't
Hoff η χημική ισορροπία θα μετατοπισθεί προς τα αριστερά με αποτέλεσμα
να ελαττωθεί ο βαθμός ιονισμού του οξέος. Μπορούμε να δούμε καλύτερα το
φαινόμενο αυτό, μελετώντας το παρακάτω παράδειγμα:
ΠΑΡΑΔΕΙΓΜΑ
Α) Ποιος είναι ο βαθμός ιοντισμού διαλύματος CH3COOH 0,1 M ;
Β) Ποιος είναι ο βαθμός ιοντισμού του παραπάνω διαλύματος όταν σε ένα λίτρο του προστεθούν 0,1 mole HCl;
Δίνεται Κa = 10-5
ΛΥΣΗ
Α) Το CH3COOH διίσταται σύμφωνα με την αντίδραση:
![]()
| CH3COOH | Η3Ο+ | CH3COO- | ||
| Aρχικά |
|
|||
| Ιονίζονται |
|
|||
| Παράγονται |
|
|
||
| Ιοντική ισορροπία |
|
|
|
Η Ka του οξέος θα είναι:
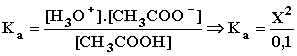
Άρα x2 = 10-5.0,1και τελικά x = 10-3
Θεωρήσαμε ότι 0,1 -
x = 0,1 διότι ![]() οπότε
τελικά,
οπότε
τελικά,
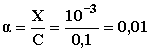
B) To HCl επειδή είναι ισχυρός ηλεκτρολύτης, διίσταται σύμφωνα με την αντίδραση
|
|
|||
| 0,1 Μ | 0,1 Μ | 0,1 Μ | |
![]()
| CH3COOH | Η3Ο+ | CH3COO- | ||
| Αρχικά |
|
|
||
| Ιονίζονται |
|
|||
| Παράγονται |
|
|
||
| Ιοντική ισορροπία |
|
|
|
Η Ka του οξέος θα είναι:
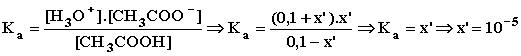
Θεωρήσαμε ότι [CH3COOH]
= 0,1 - x' =0,1 και
[ H3O+] = 0,1 + x' = 0,1
διότι ![]()
Τελικά, α’
= 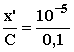 =10-4
=10-4
Παρατηρούμε την διαφορά στον βαθμό ιονισμού, από α = 0,01 σε α’ = 0,0001.

Ρυθμιστικά ηλεκτρολυτικά διαλύματα ή συστήματα
![]()
Αν θέσουμε Cβασ την συγκέντρωση του Α- ( η Α- είναι η συζυγής βάση του ΗΑ.) Η Cβασ θα είναι βέβαια, σαν αριθμητική τιμή, ίδια με την αρχική συγκέντρωση του άλατος.
Η αντίδραση ιονισμού του ασθενούς οξέος, που η συγκέντρωσή του είναι Cοξ γράφεται:
![]()
| ΗΑ | Α- | Η3Ο+ | ||
| Αρχικά |
|
|
||
| Ιονίζονται |
|
|||
| Παράγονται |
|
|
||
| Ιοντική ισορροπία |
|
|
|
Η ύπαρξη του κοινού ιόντος Α- αναμένεται να περιορίσει τον ιονισμό του ασθενούς οξέος, δηλ. η ισορροπία θα μετατοπισθεί προς τα αριστερά.
Από την σταθερά ιονισμού του οξέος προκύπτει :
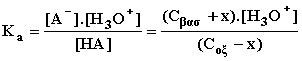 (1)
(1)
Επειδή όμως το x είναι
πολύ μικρό, δηλ. 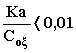 το x μπορεί
να παραληφθεί οπότε προκύπτει:
το x μπορεί
να παραληφθεί οπότε προκύπτει:
![]() (2)
(2)
Με λογαρίθμηση και των δύο μελών της (2) και πολλαπλασιασμό με -1 έχουμε:
![]()
και τελικά
![]() (3)
(3)
Η σχέση (3) είναι γνωστή σαν εξίσωση των Henderson - Hasselbalch. Αν η Cβασ είναι ίδια με την Cοξ, τότε το pH=pKa. Ακριβώς όμοια πράγματα ισχύουν και για τα ρυθμιστικά διαλύματα του τύπου NH4Cl και NH3. Στην περίπτωση αυτή οξύ είναι το ιόν ΝΗ4+ και η συζυγής βάση του είναι η ΝΗ3 και ο αντίστοιχος τύπος είναι:
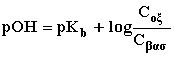 (4)
(4)
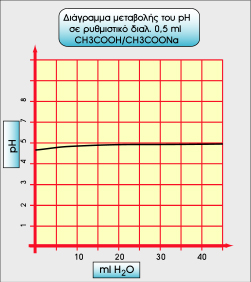
Αν αραιώσουμε το διάλυμα, τότε θα μεταβληθεί και η Cοξ και η Cβασ, όμως το κλάσμα
Βλέπε τα παρακάτω διαγράμματα.
 |
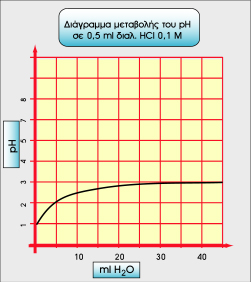 |
Διακρίνουμε λοιπόν τις παρακάτω περιπτώσεις:
![]()
οπότε το pH πάλι δεν μεταβάλλεται
σημαντικά.![]()
ΠΑΡΑΔΕΙΓΜΑ
α) Υπολογίστε το pH διαλύματος που περιέχει CH3COOH 0,2 M και CH3COONa 0,3 M
β) Ποιο θα ήταν το pH του διαλύματος του CH3COOH 0,2 M χωρίς την παρουσία άλατος; Δίδεται Ka = 1,8.10-5
ΛΥΣΗ
α) Πρώτα υπολογίζουμε το pKa από το Ka,
pKa = -logKa = -log(1,8.10-5) = 4,74.
Κατόπιν εφαρμόζοντας την σχέση έχουμε
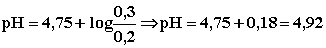
Άρα το pH του ρυθμιστικού διαλύματος θα είναι 4,92. Μελετώντας το παραπάνω αποτέλεσμα διαπιστώνουμε ότι το pH ενός ρυθμιστικού διαλύματος καθορίζεται βασικά από την Ka του ασθενούς οξέος και λιγότερο από τις συγκεντρώσεις των συστατικών του.
β) Το οξικό οξύ ιονίζεται σύμφωνα με το σχήμα:
![]()
| CH3COOH | CH3COO- | Η3Ο+ | ||
| Αρχικά |
|
|||
| Ιονίζονται |
|
|||
| Παράγονται |
|
|
||
| Ιοντική ισορροπία |
|
|
|
Οπότε για την Ka του οξέος έχουμε:
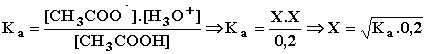
θεωρήσαμε δηλαδή ότι το Χ είναι πολύ μικρό
σε σχέση με την αρχική συγκέντρωση του οξέος, διότι ![]()
οπότε [CH3COOH] = 0,2
![]()
οπότε τελικά pH = -log1,9.10-3 δηλ. pH = 2,72.
Σαν συμπέρασμα μπορούμε να πούμε ότι λόγω της ύπαρξης
κοινού ιόντος ο ιονισμός του οξέος έχει περιοριστεί σημαντικά, γι' αυτό
και το pH από 2,72
έγινε 4,92.
Να γραφεί η αντίδραση.