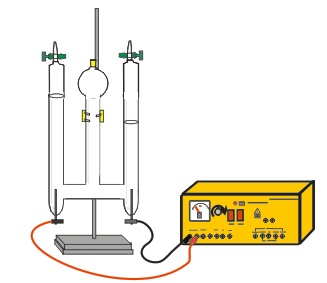
H+ (aq) + HSO4-(aq) και HSO4-(aq)
H+ (aq) + HSO4-(aq) και HSO4-(aq) 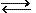 H+ (aq) + SO42-(aq)
H+ (aq) + SO42-(aq) Στο διάλυμα H2SO4 γίνονται οι εξής αντιδράσεις:
α) Αντιδράσεις ιοντισμού του διαλύματος του H2SO4:
H2SO4(aq)  H+ (aq) + HSO4-(aq) και HSO4-(aq)
H+ (aq) + HSO4-(aq) και HSO4-(aq) 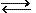 H+ (aq) + SO42-(aq)
H+ (aq) + SO42-(aq)
β) Αντίδραση ιοντισμού του νερού:
H2O(l) 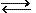 H+(aq) + OH-(aq)
H+(aq) + OH-(aq)
Επομένως στο διάλυμα εμφανίζονται τα εξής :SO42-, HSO4-(aq) , H+, OH- ενώ υπάρχουν και μόρια H2O που δεν έχουν ιοντιστεί
Αν υπάρχουν ηλεκτρόδια στο διάλυμα στην κάθοδο θα προτιμηθεί η αντίδραση: 2Η+(aq) + 2e-  Η2(g)
Η2(g)
Στην άνοδο θα κινηθούν τα αρνητικά ιόντα και το H2O. Μεταξύ αυτών στη σειρά εκφόρτισης προηγούνται τα Η2Ο. Στην άνοδο θα προτιμηθεί η αντίδραση αντίδραση:
Η2Ο(l) 2Η+(aq) + ½Ο2(g) + 2e->
2Η+(aq) + ½Ο2(g) + 2e->
Συνολικό αποτέλεσμα της ηλεκτρόλυσης είναι τελικά: Η2Ο(l)  Η2(g) + ½Ο2(g)
Η2(g) + ½Ο2(g)
| Συσκευή ηλεκτρόλυσης Hoffman με ηλεκτρόδια Pt | H2SO4 20% |
| Μετασχηματιστής 16V | |
| Χωνί διήθησης | |
| Λεκάνη γυάλινη | |
| 2 καλώδια σύνδεσης με κροκοδειλάκια | |
| 1 δοκιμαστικός σωλήνας | |
| Παρασχίδα ανίχνευσης οξυγόνου | |
| Αναπτήρας |