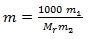 (2), όπου m1 η
μάζα της διαλυμένης ουσίας, m2 η μάζα
του διαλύτη και Mr η σχετική μοριακή
μάζα της διαλυμένης ουσίας Από τις σχέσεις
(1) και (2) είναι δυνατός ο υπολογισμός της
σχετικής μοριακής μάζας της διαλυμένης
ουσίας
(2), όπου m1 η
μάζα της διαλυμένης ουσίας, m2 η μάζα
του διαλύτη και Mr η σχετική μοριακή
μάζα της διαλυμένης ουσίας Από τις σχέσεις
(1) και (2) είναι δυνατός ο υπολογισμός της
σχετικής μοριακής μάζας της διαλυμένης
ουσίας Εισαγωγή
Η ταπείνωση του σημείου πήξεως ενός
διαλύτη δίνεται από την σχέση Δθ=Κ•m, (1)
όπου K είναι κρυοσκοπική σταθερά
χαρακτηριστική για κάθε διαλύτη, και m η
μοριακή συγκέντρωση . κατά μάζα (δηλαδή τα
mol διαλυμένης ουσίας σε 1000 g διαλύτη). Το m θα
ισούται με: 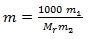 (2), όπου m1 η
μάζα της διαλυμένης ουσίας, m2 η μάζα
του διαλύτη και Mr η σχετική μοριακή
μάζα της διαλυμένης ουσίας Από τις σχέσεις
(1) και (2) είναι δυνατός ο υπολογισμός της
σχετικής μοριακής μάζας της διαλυμένης
ουσίας
(2), όπου m1 η
μάζα της διαλυμένης ουσίας, m2 η μάζα
του διαλύτη και Mr η σχετική μοριακή
μάζα της διαλυμένης ουσίας Από τις σχέσεις
(1) και (2) είναι δυνατός ο υπολογισμός της
σχετικής μοριακής μάζας της διαλυμένης
ουσίας
Απαιτούμενα όργανα και ουσίες
| Δοκιμαστικός σωλήνας μεγάλος | Βενζόλιο |
| Ποτήρι ζέσεως 50 mL | Ιώδιο |
| Ποτήρι ζέσεως 600 mL με πάγο | |
| Χάλκινο σύρμα με άκρο μορφής δακτυλίου | |
| Θερμόμετρο | |
| Ζυγός ακριβείας ±0,1 g |
Πορεία του πειράματος
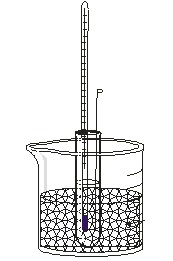
Σημειώστε το σημείο πήξεως του βενζολίου: θ1=________________________
Σημειώστε το σημείο πήξεως του διαλύματος βενζολίου - ιωδίου: θ2=________________________
____________________________________________________________
____________________________________________________________
____________________________________________________________
____________________________________________________________