ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΝΟΜΟΥ ΤΑΧΥΤΗΤΑΣ ΑΝΤΙΔΡΑΣΗΣ
Α. Εργαστηριακός οδηγός
Εισαγωγή
Σε αυτό το πείραμα θα προσδιορίσουμε το νόμο της ταχύτητας της αντίδρασης:
Η2Ο2 + 2 Ι- + Η+  Ι2 + 2 Η2Ο
Ι2 + 2 Η2Ο
αν γνωρίζουμε ότι ο νόμος είναι ανεξάρτητος από την συγκέντρωση των [Η+]
Ο νόμος θα έχει την μορφή:
V = k·[H2O2]x· [I-]y
Η ταχύτητα V μπορεί να υπολογιστεί από τον ρυθμό κατανάλωσης των αντιδρώντων ή τον ρυθμό εμφάνισης των προϊόντων, άρα και από την σχέση
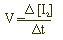
Προκειμένου να καθοριστεί ο ρυθμός εμφάνισης του ιωδίου θα χρησιμοποιήσουμε μια δεύτερη ταυτόχρονη αλλά και πολύ γρήγορη αντίδραση:
Ι2 + 2 S2O3 2-  Ι- + S4O6 2-
Ι- + S4O6 2-
αλλά και από την ιδιότητα του Ι2 να χρωματίζει μπλε το διάλυμα αν σε αυτό υπάρχει μικρή ποσότητα αμύλου
Η ύπαρξη συγκεκριμένης ποσότητας S2O3 2- στο διάλυμα καταναλώνει την όποια ποσότητα Ι2 παράγεται από την προς μελέτη αντίδραση. Μέχρι δηλαδή να καταναλωθεί όλη η ποσότητα των S2O3 2- το διάλυμά μας διατηρείται διαυγές, αφού το Ι2 μετατρέπεται ταχέως σε Ι-.
Όταν καταναλωθεί όλη η ποσότητα των S2O3 2- θα έχει καταναλωθεί η μισή ποσότητα των Ι2 σύμφωνα με την αντίδραση. Τότε το διάλυμα χρωματίζεται μπλε ενώ μπορούμε να προσδιορίσουμε το χρόνο Δt από την έναρξη των αντιδράσεων έως την εμφάνιση του μπλε χρώματος. Οπότε η ταχύτητα V προσδιορίζεται από τις σχέσεις:
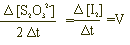
Μετρώντας τρεις φορές με την παραπάνω μέθοδο την ταχύτητα της αντίδρασης για διαφορετικές αρχικές συγκεντρώσεις [Η2Ο2] και [I-] μπορούμε να προσδιορίσουμε τους αγνώστους k, x και y του νόμου ταχύτητας, όπου τα x και y είναι ακέραιοι αριθμοί..
Απαιτούμενα όργανα και αντιδραστήρια
| 3 ποτήρια ζέσης 250 mL | H2O |
| 3 ράβδοι ανάδευσης | H2SO4 1,0 M |
| ογκομετρικός κύλινδρος 100 mL | Δείκτης αμύλου |
| 2 ογκομετρικοί κύλινδροι 25 mL | KI 0,10 M |
| σιφώνιο πληρώσεως 10 mL | Na2S2O3 0,010 M |
| πουάρ τριών σημείων | H2O2 0,10 M |
| χρονόμετρο | |
Πειραματική διαδικασία
- Σε ογκομετρικό κύλινδρο 100 mL προσθέτουμε 60 mL νερό, 10 mL Η2SO4 1M. Αδειάζουμε το περιεχόμενο του κυλίνδρου σε ένα ποτήρι 250 mL (Νo 1). Με την βοήθεια ογκομετρικού κυλίνδρου των 25 mL προσθέτουμε στο ποτήρι 10 mL KI 0,1 M, με την βοήθεια σιφωνίου πληρώσεως 10 mL Na2S2O3 0,01 Μ. και με το σταγονομετρικό φιαλίδιο 10 σταγόνες δείκτη αμύλου.
- Τέλος προσθέτουμε με την βοήθεια ογκομετρικού κυλίνδρου 10 mL Η2Ο2 0,1 Μ ενεργοποιώντας ταυτόχρονα το χρονόμετρο.
- Μόλις εμφανιστεί μπλε χρώμα στο ποτήρι αμέσως σταματάμε το χρονόμετρο και σημειώνουμε το χρόνο στο φύλλο εργασίας (στήλη 4 πίνακα αποτελεσμάτων).
- Σε δεύτερο ποτήρι 250 mL (Νo 2) προσθέτουμε με το ίδιο τρόπο που περιγράφηκε παραπάνω για το κάθε συστατικό 50 mL νερό, 10 mL Η2SO4 1M, 10 mL KI 0,1 M, 10 mL Na2S2O2 0,01 Μ, και 10 σταγόνες δείκτη αμύλου.
- Τέλος προσθέτουμε 20 mL Η2Ο2 0,1 Μ ενεργοποιώντας ταυτόχρονα το χρονόμετρο.
- Μόλις εμφανιστεί μπλε χρώμα στο ποτήρι αμέσως σταματάμε το χρονόμετρο και σημειώνουμε το χρόνο στο φύλλο εργασίας.
- Σε τρίτο ποτήρι 250 mL (Νo 3) προσθέτουμε με το ίδιο τρόπο που περιγράφηκε παραπάνω για το κάθε συστατικό 50 mL νερό, 10 mL Η2SO4 1M, 20 mL KI 0,1 M, 10 mL Na2S2O2 0,01 Μ. και 10 σταγόνες δείκτη αμύλου.
- Τέλος προσθέτουμε με την βοήθεια ογκομετρικού κυλίνδρου 10 mL Η2Ο2 0,1 Μ ενεργοποιώντας ταυτόχρονα το χρονόμετρο.
- Μόλις εμφανιστεί μπλε χρώμα στο ποτήρι αμέσως σταματάμε το χρονόμετρο και σημειώνουμε το χρόνο στο φύλλο εργασίας.
Β. Φύλλο εργασίας
- Με βάση τον εργαστηριακό οδηγό τα προστιθέμενα αντιδρώντα σε κάθε ποτήρι εμφανίζονται στον παρακάτω πίνακα:
Μίγματα αντίδρασης
| Πείραμα | δ. KI 0,1 M (mL) | δ. H2O2 0,1 M (mL) | δ. Na2S2O2 0,01 M (mL) | Όγκος μίγματος (mL) |
| 1 | 10 | 10 | 10 | 100 |
| 2 | 10 | 20 | 10 | 100 |
| 3 | 20 | 10 | 10 | 100 |
- Υπολογίστε την αρχική συγκέντρωση [Ι-] για κάθε ποτήρι την στιγμή έναρξης των αντιδράσεων και συμπληρώστε την στήλη 1 του πίνακα αποτελεσμάτων
- Υπολογίστε την αρχική συγκέντρωση [Η2Ο2] για κάθε ποτήρι την στιγμή έναρξης των αντιδράσεων και συμπληρώστε την στήλη 1 του πίνακα αποτελεσμάτων.
- Υπολογίστε την μεταβολή συγκέντρωσης των [S2Ο32-]τελ - [S2Ο22-]αρχ (που είναι κοινή για κάθε ποτήρι) όπου τελική συγκέντρωση είναι όταν εμφανιστεί μπλε χρώμα στο διάλυμα και συμπληρώστε την στήλη 3 του πίνακα αποτελεσμάτων.
- Στην στήλη 4 γράψτε αντίστοιχα τους χρόνους σε s που μετρήσατε σε κάθε πείραμα
- Στην στήλη 5 τη ταχύτητα κατανάλωσης του [S2Ο32-]
Πίνακας αποτελεσμάτων
| α/α | 1 | 2 | 3 | 4 | 5 | 6 |
| Αρχική [Ι-] (Μ) | Αρχική [Η2Ο2] (Μ) | Δ [S2O22-] (M) | Δt (s) | 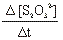 (M/s) (M/s) | Vαντίδρασης (M/s) |
| 1 | | | | | | |
| 2 | | | | | | |
| 3 | | | | | | |
- Παίρνουμε τρεις εξισώσεις από την σχέση V = k·[H2O2]x· [I-]y μία για κάθε πείραμα και δημιουργούμε σύστημα εξισώσεων με αγνώστους τα k, x και y. (προτείνεται για ευκολότερη λύση η διαίρεση κατά μέλη ανά δύο των εξισώσεων (2):(1) και (3):(1) και εύρεση των x, και y με προσέγγιση στο γειτονικό ακέραιο).
 Ι2 + 2 Η2Ο
Ι2 + 2 Η2Ο Ι2 + 2 Η2Ο
Ι2 + 2 Η2Ο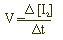
 Ι- + S4O6 2-
Ι- + S4O6 2-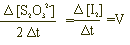

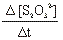 (M/s)
(M/s)