

Αντιδράσεις:
Από τη Γ Λυκείου
Αντιδράσεις οξείδωσης - αναγωγής
Οι αντιδράσεις οξείδωσης - αναγωγής στην οργανική χημεία διέπονται από τις γενικές αρχές που αναπτύχθηκαν
στο κεφάλαιο της οξειδοαναγωγής στη Β΄ Λυκείου. Να θυμηθούμε λοιπόν τους ορισμούς :
Οξείδωση είναι η αύξηση του αριθμού οξείδωσης ατόμου ή ιόντος.
Αναγωγή είναι η ελάττωση του αριθμού οξείδωσης ατόμου ή ιόντος.
Ειδικά βέβαια στην οργανική μπορούμε να θεωρήσουμε:
Οξείδωση είναι η μείωση της ηλεκτρονιακής πυκνότητας του C η οποία προκαλείται:
- με σχηματισμό των δεσμών C-O, C-N, C-X ή
- με διάσπαση των δεσμών C-H.
Αναγωγή είναι η αύξηση της ηλεκτρονιακής πυκνότητας του C η οποία προκαλείται:
- με σχηματισμό των δεσμών C-H ή
- με διάσπαση των δεσμών C-O, C-N, C-X.
Να παρατηρήσουμε ότι πολλές από τις αντιδράσεις στις οποίες έχουμε ήδη αναφερθεί, όπως αντιδράσεις
προσθήκης, απόσπασης, υποκατάστασης, μπορούν να ενταχθούν στην κατηγορία της οξείδωσης - αναγωγής.
Για παράδειγμα φέρνουμε την προσθήκη του Br2 σε αιθένιο:
-2 0 -1 -1
![]()
Ο C οξειδώνεται από Α.Ο. = -2 σε -1 και το Br ανάγεται από Α.Ο. = 0 σε -1. Επίσης μπορούμε να πούμε ότι το
CH2 = CH2 οξειδώνεται, επειδή σχηματίζονται δύο δεσμοί C-Br.
Αντιδράσεις οξείδωσης - αναγωγής που παρουσιάζουν ιδιαίτερο ενδιαφέρον στην οργανική χημεία είναι οι εξής:
- Οξείδωση αλκοολών
![]()
Οι πρωτοταγείς αλκοόλες οξειδώνονται σε αλδεΰδες (διάσπαση ενός δεσμού C-H ) και στη συνέχεια σε οξέα
(σχηματισμός ενός δεσμού C-O), σύμφωνα με το σχήμα:
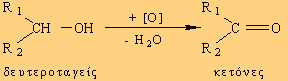
Οι δευτεροταγείς αλκοόλες οξειδώνονται σε κετόνες (διάσπαση ενός δεσμού C-H ):
Από τα πιο κοινά οξειδωτικά μέσα για την οξείδωση των αλκοολών είναι το όξινο διάλυμα KMnO4 και το όξινο
διάλυμα K2Cr2O7. Το πρώτο (KMnO4) έχει χρώμα ιώδες και μετατρέπεται σε άχρωμο Mn2+. Το δεύτερο
(K2Cr2O7 ) είναι πορτοκαλί και μετατρέπεται σε πράσινο (Cr3+). Το όξινο διάλυμα KMnO4 είναι ισχυρότερο
οξειδωτικό από το K2Cr2O7 και οδηγεί τις πρωτοταγείς αλκοόλες αποκλειστικά σε καρβοξυλικά οξέα. Αντίθετα,
η οξείδωση μιας πρωτοταγούς αλκοόλης μέχρι το στάδιο της αλδεΰδης γίνεται συνήθως με K2Cr2O7.
Οι πρωτοταγείς αλκοόλες μπορούν επίσης να οξειδωθούν σε αλδεΰδες και οι δευτεροταγείς αλκοόλες σε κετόνες
με θέρμανση παρουσία χαλκού (καταλυτική αφυδρογόνωση).
Οι κετόνες και οι τριτοταγείς αλκοόλες δεν οξειδώνονται παρά μόνο σε πολύ δραστικές συνθήκες με διάσπαση
του μορίου τους.
- Oξείδωση αλδεΰδης
Οι αλδεΰδες δεν οξειδώνονται μόνο από τα αντιδραστήρια που οξειδώνουν τις πρωτοταγείς και δευτεροταγείς
αλκοόλες (KMnO4 και K2Cr2O7), αλλά και με πολύ ήπια οξειδωτικά μέσα, όπως είναι:
.
Το αντιδραστήριο Fehling (Φελίγγειο υγρό), που είναι αλκαλικό διάλυμα ιόντων Cu2+, γαλάζιου χρώματος και
το οποίο ανάγεται σε καστανέρυθρό ίζημα Cu2O, σύμφωνα με τη χημική εξίσωση:
![]()
Το αντιδραστήριο Tollens, που είναι αμμωνιακό διάλυμα AgNO3, οξειδώνει την αλδεϋδη σε οξύ, ενώ ταυτόχρονα
ο Ag+ μετατρέπεται σε Ag, ο οποίος σχηματίζει στα τοιχώματα του δοχείου που γίνεται η αντίδραση κάτοπτρο
(καθρέπτη). ![]()
Oι δύο παραπάνω αντιδράσεις χρησιμοποιούνται για την ανίχνευση των αλδεϋδών.


Φελίγγειο υγρό και το αντιδραστήριο Tollens μετά την προσθήκη αλδεϋδης.
3. Οξείδωση μεθανικού οξέος και αλάτων του και οξαλικού οξέος (αιθανοδιικού) και αλάτων του.
![]()
![]()

Το παραγόμενο CO2 προκαλεί θόλωμα σε ασβεστόνερο -διάλυμα Ca(OH)2, όπως φαίνεται στο παρακάτω σχήμα:
Η συμπλήρωση των οργανικών αντιδράσεων οξείδωσης - αναγωγής, όπως αυτών που αναφέραμε παραπάνω, γίνεται με την ίδια σκέψη που κάναμε για τη συμπλήρωση την των ανόργανων αντιδράσεων οξειδοαναγωγής.

Η συνολική μεταβολή του Α.Ο. σε μια οργανική ένωση την μπορεί να υπολογιστεί με βάση τους εξής πρακτικούς κανόνες:
Παράδειγμα 5.7
α. Οξείδωση RCH2OH σε RCHO με διάλυμα KMnO4 παρουσία H2SO4
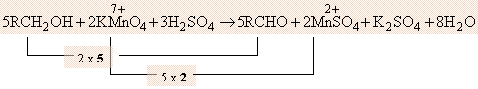
Κατά την οξείδωση αλκοόλης RCH2OH σε αλδεϋδη RCHO παρατηρείται αύξηση. Α.Ο. = 2, γιατί η αλκοόλη χάνει 2 άτομα Η.
β. Οξείδωση RCH2OH σε RCOOH με διάλυμα K2Cr2O7 παρουσία H2SO4.

Κατά την οξείδωση RCH2OH --> RCOOH υπολογίζουμε ότι η συνολική αύξηση του Α.Ο. είναι 4, γιατί η ένωση
χάνει 2 άτομα Η και κερδίζει 1 άτομο οξυγόνου (2+2=4).
γ. Οξείδωση HCOOH σε CO2 με διάλυμα KΜnO4 παρουσία HsSO4.
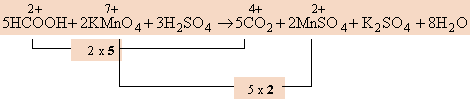
Εδώ ήταν εύκολο να βρούμε τη μεταβολή από τον Α.Ο. του C στο HCOOH και στο CΟ2.
δ. Η οξείδωση (COONa)2 σε CO2 με KMnO4 παρουσία H2SO4
H συνολική αύξηση του Α.Ο. είναι 2 γιατί χάνει 2 άτομα Na.
![]()
ε. Οξείδωση RCHO σε RCOOH (που δημιουργεί RCOONa) με διάλυμα Fehling (CuSO4 + NaΟΗ).
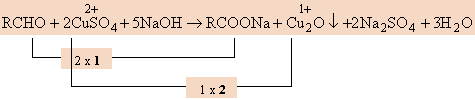
στ. Οξείδωση RCHO σε RCOOH (που δημιουργεί RCOONH4) με αμμωνιακό διάλυμα AgNO3.
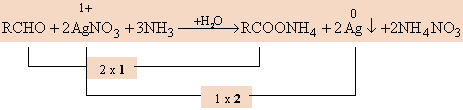
- Αντιδράσεις αναγωγής οργανικών ενώσεων
Στις αντιδράσεις αυτές μπορούν να ενταχθούν οι αντιδράσεις προσθήκης με υδρογόνο των αλκενίων, αλκινίων, αλδεϋδών, κετονών και νιτριλίων. π.χ. CH3C≡N + 2H2 --> CH3CH2NH2
Αλδεΰδες - Κετόνες
Η διάκριση μεταξύ αλδεϋδών και κετονών στηρίζεται στην ιδιότητα των αλδεΰδων να οξειδώνονται ακόμα και με ήπια οξειδωτικά, ενώ οι κετόνες δεν οξειδώνονται.
1. Για να εξακριβώσουμε αν μία ένωση είναι αλδεΰδη ή κετόνη, ελέγχουμε αν αντιδρά με φελίγγειο υγρό. Aν αντιδρά είναι αλδεΰδη, αν δεν αντιδρά είναι κετόνη. Η ίδια διάκριση μπορεί να πραγματοποιηθεί με αντιδραστήριο Tollen’s (αμμωνιακό διάλυμα νιτρικού αργύρου).
Αντίδραση με φελίγγειο υγρό
![]()
Το αποτέλεσμα της αντίδρασης αυτής είναι ο σχηματισμός κεραμέρυθρου ιζήματος Cu2O.
Αντίδραση με αμμωνιακό διάλυμα AgNO3
![]()
Το αποτέλεσμα της αντίδρασης αυτής είναι η αποβολή Ag στον πυθμένα του δοχείου (συχνά υπό μορφή κατόπτρου).
Η ιστοσελίδα αυτή δημιουργήθηκε στο ΔιΧηΝΕΤ από τη Γκιγκούδη Αναστασία με τη βοήθεια του Νίκου Μπεκιάρη