
Αντιδράσεις:
Από τη Γ Λυκείου
Αντιδράσεις προσθήκης
Οι σπουδαιότερες αντιδράσεις προσθήκης είναι:
Προσθήκη στο διπλό δεσμό > C = C <
π.χ. CH2 = CH2 + Br2--> CH2BrCH2Br
Γενικά, αν προσθέσουμε αλκένιο σε διάλυμα Br2 σε τετραχλωράνθρακα, τότε το αλκένιο αντιδρά με το Br2 και το διάλυμα του Br2, από κόκκινο που είναι, αποχρωματίζεται. Ανάλογες αντιδράσεις προσθήκης με Br2 δίνουν και άλλοι ακόρεστοι υδρογονάνθρακες. Γενικότερα, η προσθήκη Br2 αποτελεί ένα απλό εργαστηριακό έλεγχο της ακορεστότητας, καθώς η άμεση εξαφάνιση της κόκκινης χροιάς του Br2 σημαίνει ότι η ένωση είναι ακόρεστη.
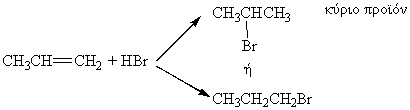
Κατά την προσθήκη HBr ή ΗΟΗ ή ΗΑ στο προπένιο είναι δυνατόν να σχηματιστούν δύο προϊόντα
Το κύριο προϊόν, δηλαδή αυτό που σχηματίζεται σε πολύ μεγαλύτερη ποσότητα από το άλλο, προβλέπεται από τον κανόνα του Markovnikov.
Σύμφωνα με τον κανόνα του Markovnikov: όταν ένα μόριο ΑΒ προστίθεται στο διπλό δεσμό ενός μη συμμετρικού αλκενίου το κύριο προϊόν της αντίδρασης είναι αυτό που προκύπτει από την προσθήκη του θετικού τμήματος (το οποίο είναι συνήθως Ηδ+) στον άνθρακα με τα περισσότερα υδρογόνα.
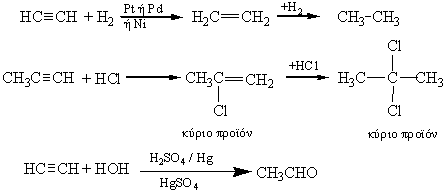
Προσθήκη στον τριπλό δεσμό ![]()
Οι αντιδράσεις αυτές μοιάζουν πολύ με τις αντίστοιχες αντιδράσεις προσθήκης του διπλού δεσμού, με τη διαφορά ότι εδώ καταναλώνεται διπλάσια ποσότητα αντιδραστηρίου απ’ ότι στο διπλό δεσμό, καθώς η προσθήκη γίνεται σε δύο βήματα. Πρώτα, προστίθεται ένα μόριο στον τριπλό δεσμό, οπότε προκύπτει ένωση με διπλό δεσμό και στη συνέχεια προστίθεται άλλο νέο μόριο, ώστε ο διπλός δεσμός να γίνει απλός.
Επίσης, οι αντιδράσεις προσθήκης στα ασύμμετρα αλκίνια ακολουθούν τον κανόνα του Markovnikov. Τέλος, να προσέξουμε την προσθήκη νερού στα αλκίνια, που όπως θα εξηγήσουμε στο παρακάτω παράδειγμα, γίνεται σε ένα στάδιο.
Παράδειγμα 5.6
Στην τελευταία αντίδραση σχηματίζεται ενδιάμεσα η ασταθής ένωση CH2=CH-OH (ενόλη) η οποία μετατρέπεται στη συνέχεια σε καρβονυλική ένωση.
Προσθήκη στο καρβονύλιο των αλδεϋδών και κετονών:![]()
Το ηλεκτρονιακό νέφος του καρβονυλικού διπλού δεσμού είναι ισχυρά μετατοπισμένο προς την πλευρά του ηλεκτραρνητικότερου ατόμου, δηλαδή του οξυγόνου. Γι’ αυτό και ο καρβονυλικός διπλός δεσμός, σε αντίθεση με το διπλό δεσμό των αλκενίων, είναι ισχυρά πολωμένος. Εξ’ αιτίας αυτού οι καρβονυλικές ενώσεις δίνουν εύκολα αντιδράσεις προσθήκης με ενώσεις του τύπου:![]()
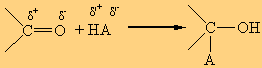
σύμφωνα με το σχήμα:
Η σειρά δραστικότητας των καρβονυλικών ενώσεων, όσον αφορά τις αντιδράσεις προσθήκης, είναι:
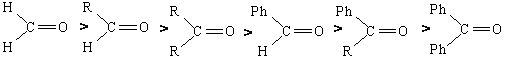
Όπου, R- είναι αλκύλιο (CνΗ 2ν+1-) και Ph- είναι φαινύλιο (C6H5-)
Xαρακτηρηστικά παραδείγματα αντιδράσεων προσθήκης στο καρβονύλιο είναι:
1. Η προσθήκη Η2 προς σχηματισμό αλκοολών
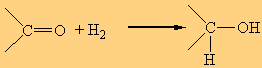
2. Η προσθήκη HCN, προς σχηματισμό κυανιδρινών
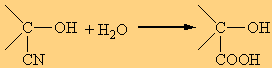
Η υδρόλυση των κυανυδρινών οδηγεί στη σύνθεση α-υδροξυοξέων ή 2-υδροξυοξέων:
3. Η προσθήκη αντιδραστηρίων Grignard που οδηγεί τελικά, μετά από υδρόλυση, στη σύνθεση αλκοολών.
Ο Γάλλος χημικός François Grignard συνέθεσε πρώτος ενώσεις του τύπου RMgX που ονομάζονται αλκυλομαγνησιοαλογονίδια ή αντιδραστήρια Grignard προς τιμή του.
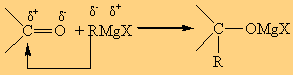
Στα αντιδραστήρια Grignard η πολικότητα είναι:
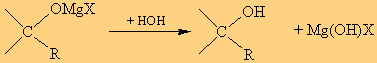
Το προϊόν της προσθήκης στη συνέχεια υδρολύεται, οπότε έχουμε:
α. Ανάλογα με το είδος της καρβονυλικής ένωσης που χρησιμοποιούμε προκύπτει και άλλη αλκοόλη. Δηλαδή,
- από φορμαλδεΰδη (HCHO) και RMgX προκύπτει η πρωτοταγής αλκοόλη της μορφής RCH2OΗ,
- από άλλες
αλδεΰδες (R1CH=O) προκύπτουν δευτεροταγείς αλκοόλες
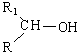
- από κετόνες
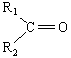 προκύπτουν τριτοταγείς αλκοόλες
προκύπτουν τριτοταγείς αλκοόλες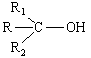
β. Στις αντιδράσεις αυτές αυξάνεται η ανθρακική αλυσίδα (αντιδράσεις ανοικοδόμησης).
γ. Τα αντιδραστήρια Grignard παρασκευάζονται κατά την επίδραση Mg σε διάλυμα RX σε απόλυτο αιθέρα.
![]()
Ο αιθέρας πρέπει να είναι απόλυτος, γιατί η παραμικρή ποσότητα νερού αντιδρά με το RMgX και δίνει αλκάνιο, οπότε καταστρέφεται το αντιδραστήριο Grignard: ![]()
Η ιστοσελίδα αυτή δημιουργήθηκε στο ΔιΧηΝΕΤ από τη Γκιγκούδη Αναστασία με τη βοήθεια του Νίκου Μπεκιάρη