6 ΚΕΦΑΛΑΙΟ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 6.ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΣΤΟΙΧΕΙΑ
Στο 6ο κεφάλαιο αναφερόμαστε στα ηλεκτρολυτικά στοιχεία και την σχέση τους με τα γαλβανικά.
Μελετούμε τις αντιδράσεις στα ηλεκτρόδια και κλείνουμε με την ηλεκτρόλυση και επαργύρωση
που είναι εφαρμογές των ηλεκτρολυτικών στοιχείων στην πράξη.
ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΣΤΟΙΧΕΙΑ ΤΟ ΓΑΛΒΑΝΙΚΟ ΣΕ ΗΛΕΚΤΡΟΛΥΤΙΚΟ ΗΛΕΚΤΡΟΛΥΣΗ
| ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΣΤΟΙΧΕΙΑ | ΜΕΤΑΤΡΟΠΗ ΓΑΛΒΑΝΙΚΟΥ ΣΕ ΗΛΕΚΤΡΟΛΥΤΙΚΟ | ΗΛΕΚΤΡΟΛΥΣΗ - ΕΠΑΡΓΥΡΩΣΗ |
| ΟΙ ΔΡΑΣΕΙΣ ΣΤΑ ΗΛΕΚΤΡΟΔΙΑ | ||
| ΣΥΓΚΡΙΣΗ ΓΑΛΒΑΝΙΚΟΥ - ΗΛΕΚΤΡΟΛΥΤΙΚΟΥ |
6.5 HΛΕΚΤΡΟΛΥΣΗ - ΓΑΛΒΑΝΟΠΛΑΣΤΙΚΗ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 6.ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΣΤΟΙΧΕΙΑ > 6.5 ΗΛΕΚΤΡΟΛΥΣΗ - ΓΑΛΒΑΝΟΠΛΑΣΤΙΚΗ
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 6.4 ΣΥΓΚΡΙΣΗ ΓΑΛΒΑΝΙΚΟΥ - ΗΛΕΚΤΡΟΛΥΤΙΚΟΥ ΣΤΟΙΧΕΙΟΥ | 1 ΚΕΦΑΛΑΙΟ |
Ηλεκτρόλυση
Ηλεκτρόλυση είναι το σύνολο των αντιδράσεων οξείδωσης και αναγωγής που λαμβάνουν χώρα σε ένα τήγμα ή διάλυμα ενός ηλεκτρολύτη, όταν εφαρμόσουμε κατάλληλη διαφορά δυναμικού στα άκρα των ηλεκτροδίων.
Κατά την ηλεκτρόλυση μπορούν να συμβούν τα εξής:
α. Ένα ιόν ή ένα μόριο σε διάλυμα μπορεί να οξειδωθεί ή να αναχθεί στο αντίστοιχο ηλεκτρόδιο.
β. Ο ίδιος ο διαλύτης (π.χ. το νερό) μπορεί να οξειδωθεί ή να αναχθεί στο αντίστοιχο ηλεκτρόδιο.
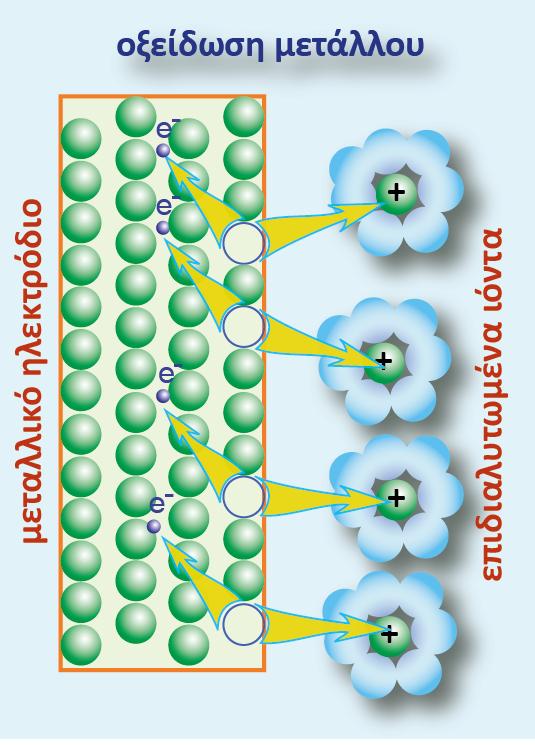
γ. Το ίδιο το μεταλλικό ηλεκτρόδιο μπορεί να οξειδωθεί ελευθερώνοντας ιόντα του μετάλλου στο διάλυμα.
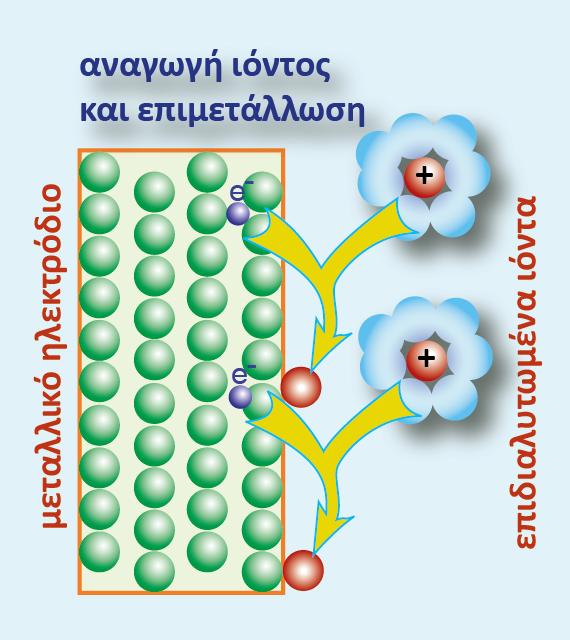
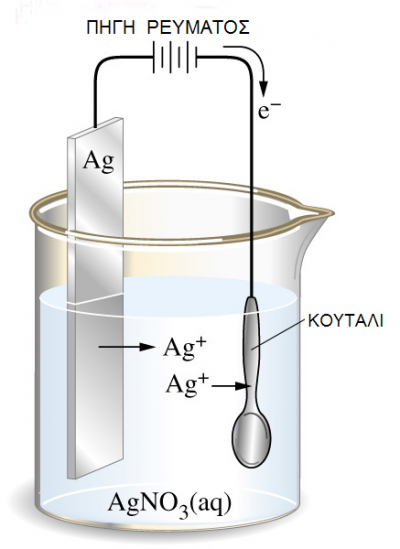
Μια σημαντική εφαρμογή της ηλεκτρόλυσης είναι η επιμετάλλωση. Στη βιομηχανία μεταλλικών αντικειμένων (μαχαιροπίρουνα, διακοσμητικά, αυτοκίνητα, κ.λ.π.) ένα αντικείμενο φτιαγμένο από ένα μέταλλο ή κράμα συχνά επικαλύπτεται από ένα στρώμα άλλου «ευγενέστερου» μετάλλου, είτε για προστασία είτε για διακόσμηση.
Μία από τις συνηθέστερες μεθόδους επιμετάλλωσης είναι με τη διαδικασία της ηλεκτρόλυσης, κατά την οποία το αντικείμενο που πρόκειται να επιμεταλλωθεί γίνεται κάθοδος και μια ποσότητα από το μέταλλο γίνεται άνοδος. Τα ηλεκτρόδια εμβαπτίζονται σε διάλυμα άλατος του ευγενούς μετάλλου και συνδέονται με πηγή συνεχούς ρεύματος.
Η επιμετάλλωση με ηλεκτρόλυση λέγεται γαλβανοπλαστική.
Η προσομοίωση σε αναδυόμενο παράθυρο
Η τεχνική της γαλβανοπλαστικής (επαργύρωση)
Στο παρακάτω σχήμα θέλουμε να επικαλύψουμε ένα μεταλλικό αντικείμενο
(π.χ. κουτάλι) κατασκευασμένο από Fe με ένα «ευγενέστερο» μέταλλο, π.χ.
Ag. Από τους πίνακες των κανονικών δυναμικών οξειδοαναγωγής γνωρίζουμε
τις τιμές των κανονικών δυναμικών οξειδοαναγωγής για τα ημιστοιχεία
Ag(s)?Ag+(aq) και Fe(s)?Fe2+(aq) : +0,80 V και ? 0,45 V αντίστοιχα.
Αν συνδυάσουμε τα δύο παραπάνω ημιστοιχεία, τότε στο γαλβανικό στοιχείο
που θα προκύψει, το ηλεκτρόδιο του Fe θα αποτελεί την άνοδο, γιατί θα
πραγματοποιείται η ημιαντίδραση οξείδωσης του Fe:
και το ηλεκτρόδιο του Ag την κάθοδο (αναγωγή των ιόντων Ag+).
Γνωρίζουμε ότι μπορούμε να μετατρέψουμε το παραπάνω γαλβανικό στοιχείο
σε ηλεκτρολυτικό, με τη χρήση κατάλληλης εξωτερικής πηγής. Για να συμβεί
αυτό, θα πρέπει ισχύουν δύο προϋποθέσεις:
? επειδή η ηλεκτρεγερτική δύναμη του γαλβανικού στοιχείου έχει τιμή
η εξωτερική πηγή πρέπει να έχει ηλεκτρεγερτική δύναμη μεγαλύτερη από
αυτή, δηλαδή: Εεξ. >1,25 V
? να συνδέσουμε το θετικό πόλο της εξωτερικής πηγής με το ηλεκτρόδιο του
Ag και τον αρνητικό πόλο με το ηλεκτρόδιο του Fe.
Όπως προκύπτει από το παρακάτω σχήμα, στο ηλεκτρόδιο του Fe αλλά και
του Ag θα πραγματοποιηθούν οι αντίστροφες ημιαντιδράσεις και αυτό έχει ως
αποτέλεσμα το ηλεκτρόδιο του Fe να αποτελεί την κάθοδο και του Ag την
άνοδο.
Μέσα στο δοχείο χρησιμοποιείται διάλυμα AgNO3 . Τελικά στο ηλεκτρόδιο του
Ag (άνοδος) πραγματοποιείται ηλεκτροδιάλυση του Ag
και στην κάθοδο (ηλεκτρόδιο του Fe) γίνεται απόθεση του Ag (επαργύρωση)
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 6.4 ΣΥΓΚΡΙΣΗ ΓΑΛΒΑΝΙΚΟΥ - ΗΛΕΚΤΡΟΛΥΤΙΚΟΥ ΣΤΟΙΧΕΙΟΥ | 1 ΚΕΦΑΛΑΙΟ |
6.3 Η ΔΡΑΣΗ ΣΤΑ ΗΛΕΚΤΡΟΔΙΑ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 6.ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΣΤΟΙΧΕΙΑ > 6.3 H ΔΡΑΣΗ ΣΤΑ ΗΛΕΚΤΡΟΔΙΑ
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 6.2 ΜΕΤΑΤΡΟΠΗ ΓΑΛΒΑΝΙΚΟΥ ΣΕ ΗΛΕΚΤΡΟΛΥΤΙΚΟ ΣΤΟΙΧΕΙΟ | 6.4 ΣΥΓΚΡΙΣΗ ΓΑΛΒΑΝΙΚΟΥ - ΗΛΕΚΤΡΟΛΥΤΙΚΟΥ ΣΤΟΙΧΕΙΟΥ |
Εποπτικός τρόπος ερμηνείας της αλλαγής των δράσεων που συμβαίνουν στα δύο ηλεκτρόδια
Ας μελετήσουμε τον τρόπο με τον οποίο μπορούμε εύκολα να προβλέψουμε τη διαφορά δυναμικού της εξωτερικής πηγής (Εεξ.) που πρέπει να εφαρμόσουμε, προκειμένου ένα γαλβανικό να το μετατρέψουμε σε ηλεκτρολυτικό στοιχείο.
Πάνω σε μια ευθεία γραμμή τοποθετούμε τις τιμές των κανονικών δυναμικών οξειδοαναγωγής γράφοντας αριστερά εκείνο το οξειδοαναγωγικό ζεύγος (Red1/Ox1) με την πιο αρνητική τιμή, όπως φαίνεται στο παρακάτω σχήμα.
Στο γαλβανικό στοιχείο πραγματοποιούνται αυθόρμητα οι ημιαντιδράσεις, όπως δηλώνονται και από τα βέλη. Στη συνέχεια υπολογίζουμε την τιμή που θα έδειχνε ένα βολτόμετρο αν το
είχαμε συνδέσει με το γαλβανικό στοιχείο.
? Αν λοιπόν σ? αυτό το γαλβανικό στοιχείο συνδέσουμε εξωτερική πηγή με Εεξ. > Εγαλβ.στοιχείου, τότε υπερισχύει το ρεύμα από την εξωτερική πηγή, αντιστρέφεται η φορά κίνησης των e- και το γαλβανικό στοιχείο μετατρέπεται σε ηλεκτρολυτικό στοιχείο.
Μπορούμε να χρησιμοποιήσουμε τον άξονα των δυναμικών (χρησιμοποιήθηκε στην παράγραφο 5.8) για να μελετήσουμε γενικότερα τη μετατροπή ενός γαλβανικού σε ηλεκτρολυτικό στοιχείο. Για να έχουμε αλλαγή της φοράς του ηλεκτρικού ρεύματος μέσα στο κύκλωμα (δηλαδή πρακτικά μετατροπή του γαλβανικού σε ηλεκτρολυτικό στοιχείο), πρέπει να συνδέσουμε το θετικό πόλο της εξωτερικής πηγής με το ηλεκτρόδιο που αποτελεί την κάθοδο του γαλβανικού στοιχείου και τον αρνητικό πόλο της εξωτερικής πηγής με το ηλεκτρόδιο που αποτελεί την άνοδο του γαλβανικού στοιχείου, όπως φαίνεται στο παρακάτω σχήμα:
Κάθοδος Red(1) / Ox(1)
Red(2) / Ox(2) Άνοδος
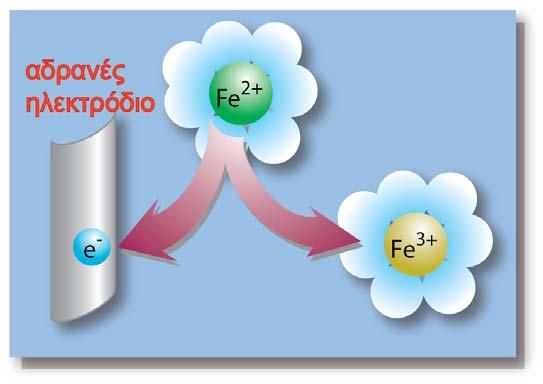
Στο ηλεκτρόδιο του γαλβανικού στοιχείου που αποτελούσε την άνοδο, επικρατούσε η ημιαντίδραση:
Με την ανάστροφη σύνδεση της εξωτερικής πηγής, το ηλεκτρόδιο που αποτελούσε την άνοδο τροφοδοτείται με e-, το δυναμικό του γίνεται αρνητικότερο από το δυναμικό ισορροπίας του και αυτό έχει ως αποτέλεσμα τη μετατόπιση της ισορροπίας προς τα αριστερά. Τελικά επικρατεί η μετατροπή της Ox(1) μορφής σε Red(1) και το ηλεκτρόδιο αυτό θα αποτελεί πια την κάθοδο του στοιχείου (αναγωγή), όπως φαίνεται από το προηγούμενο σχήμα.
Αντίθετα στο ηλεκτρόδιο του γαλβανικού στοιχείου που αποτελούσε την κάθοδο, επικρατούσε η ημιαντίδραση:
Με την ανάστροφη σύνδεση της εξωτερικής πηγής, το δυναμικό του ηλεκτροδίου γίνεται θετικότερο του πρότυπου δυναμικού του και αυτό έχει ως αποτέλεσμα, τη μετατόπιση της ισορροπίας προς τα αριστερά. Τελικά επικρατεί η μετατροπή της Red(2) μορφής σε Ox(2) και το ηλεκτρόδιο αυτό θα αποτελεί πια την άνοδο του στοιχείου(οξείδωση):
? Αν στο γαλβανικό στοιχείο συνδέσουμε εξωτερική πηγή με Εεξ. = Εγαλβ.στοιχ., τότε το κύκλωμα δεν θα διαρρέεται από ρεύμα με αποτέλεσμα να μην πραγματοποιείται καμία οξειδοαναγωγική αντίδραση.
? Αν στο γαλβανικό στοιχείο συνδέσουμε ανάστροφα εξωτερική πηγή με Εεξ.< Εγαλβ.στοιχείου, τότε το γαλβανικό στοιχείο δεν μπορεί να μετατραπεί σε ηλεκτρολυτικό και συνεχίζονται να πραγματοποιούνται οι ίδιες οξειδοαναγωγικές αντιδράσεις με μειωμένη όμως ένταση ρεύματος.
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 6.2 ΜΕΤΑΤΡΟΠΗ ΓΑΛΒΑΝΙΚΟΥ ΣΕ ΗΛΕΚΤΡΟΛΥΤΙΚΟ ΣΤΟΙΧΕΙΟ | 6.4 ΣΥΓΚΡΙΣΗ ΓΑΛΒΑΝΙΚΟΥ - ΗΛΕΚΤΡΟΛΥΤΙΚΟΥ ΣΤΟΙΧΕΙΟΥ |
6.4 ΣΥΓΚΡΙΣΗ ΓΑΛΒΑΝΙΚΟΥ - ΗΛΕΚΤΡΟΛΥΤΙΚΟΥ ΣΤΟΙΧΕΙΟΥ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 6.ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΣΤΟΙΧΕΙΑ > 6.4 ΣΥΓΚΡΙΣΗ ΓΑΛΒΑΝΙΚΟΥ - ΗΛΕΚΤΡΟΛΥΤΙΚΟΥ
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 6.3 Η ΔΡΑΣΗ ΣΤΑ ΗΛΕΚΤΡΟΔΙΑ | 6.5 HΛΕΚΤΡΟΛΥΣΗ - ΓΑΛΒΑΝΟΠΛΑΣΤΙΚΗ |
Σύγκριση γαλβανικού ? ηλεκτρολυτικού στοιχείου

| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 6.3 Η ΔΡΑΣΗ ΣΤΑ ΗΛΕΚΤΡΟΔΙΑ | 6.5 HΛΕΚΤΡΟΛΥΣΗ - ΓΑΛΒΑΝΟΠΛΑΣΤΙΚΗ |
6.2 ΜΕΤΑΤΡΟΠΗ ΓΑΛΒΑΝΙΚΟΥ ΣΕ ΗΛΕΚΤΡΟΛΥΤΙΚΟ ΣΤΟΙΧΕΙΟ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 6.ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΣΤΟΙΧΕΙΑ > 6.2 ΤΟ ΓΑΛΒΑΝΙΚΟ ΣΕ ΗΛΕΚΤΡΟΛΥΤΙΚΟ
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 6.1 ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΣΤΟΙΧΕΙΑ | 6.3 Η ΔΡΑΣΗ ΣΤΑ ΗΛΕΚΤΡΟΔΙΑ |
Μετατροπή ενός γαλβανικού στοιχείου σε ηλεκτρολυτικό στοιχείο
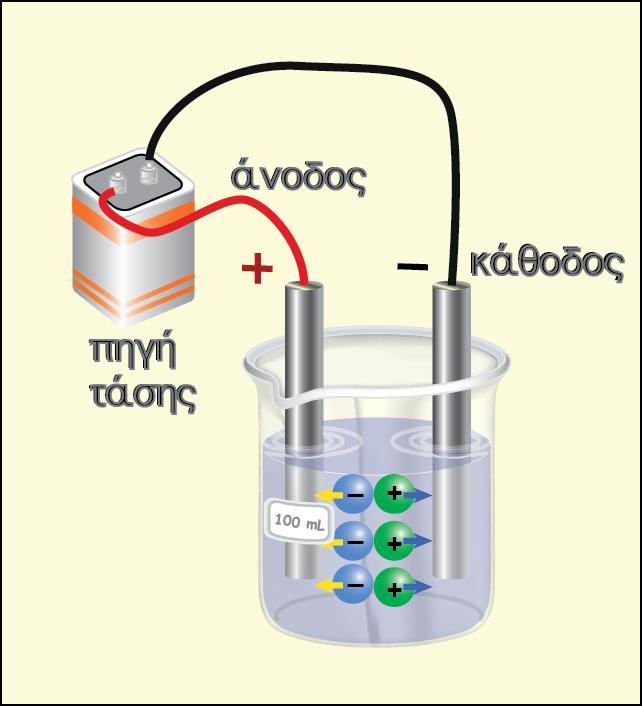
Έστω έχουμε ένα κύκλωμα που περιέχει μία πηγή Ε και διαρρέεται από ρεύμα δεξιόστροφο (σχήμα 2.1).
Σύμφωνα με τις γενικές γνώσεις του ηλεκτρισμού, γνωρίζουμε πως αν θέλουμε να αλλάξουμε τη φορά του ηλεκτρικού ρεύματος στο κύκλωμα (αριστερόστροφο), θα πρέπει να ισχύουν δύο προϋποθέσεις:
? να συνδέσουμε μια εξωτερική πηγή Εεξ ανάστροφα (δηλαδή έτσι ώστε το ρεύμα που θα δημιουργούσε αν ήταν μόνη της στο κύκλωμα να είναι αντίθετο με αυτό που δημιουργεί η πηγή Ε)
? η διαφορά δυναμικού της εξωτερικής πηγής να είναι μεγαλύτερη από αυτή που έχει η πηγή του κυκλώματος, δηλαδή να ισχύει: Εεξ.>Ε

Σύνδεση εξωτερικής πηγής ανάστροφα
Αυτό ακριβώς προκύπτει από το παραπάνω σχήμα . Παρατηρούμε ότι στο πρώτο σχήμα το ρεύμα είναι δεξιόστροφο, ενώ στο δεύτερο σχήμα άλλαξε η φορά του ρεύματος που διαρρέει το κύκλωμα (αριστερόστροφο). Το ίδιο ακριβώς μπορούμε να εφαρμόσουμε και σε ένα γαλβανικό στοιχείο.
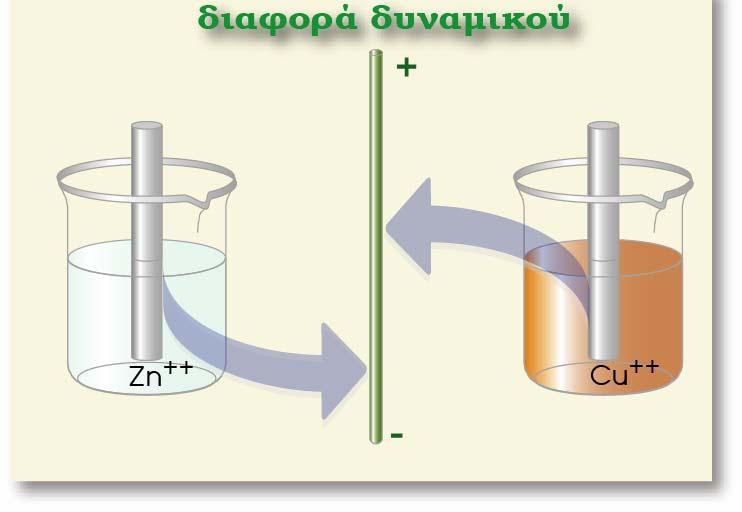
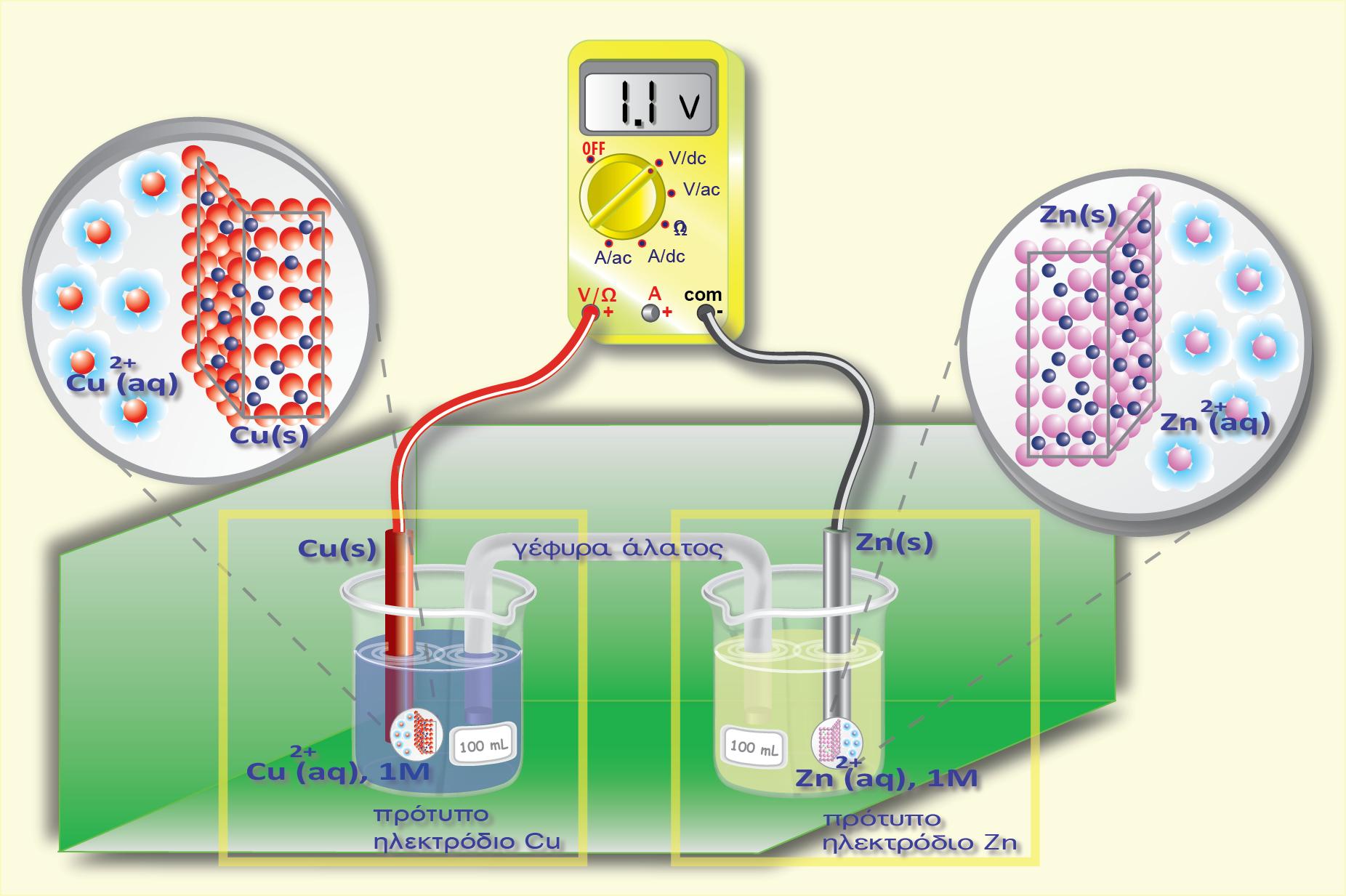
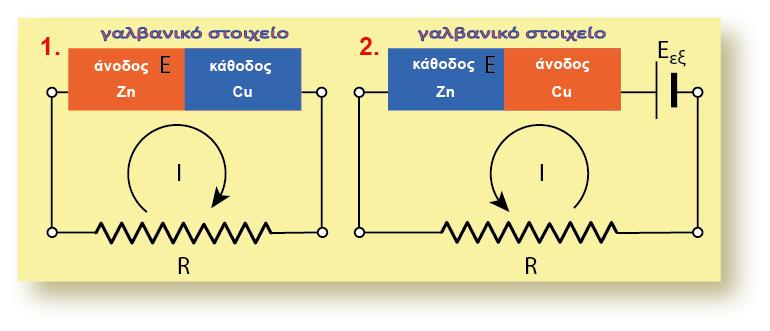
Ας μελετήσουμε το στοιχείο Daniell. Γνωρίζουμε ότι η διαφορά δυναμικού που αναπτύσσεται σ? αυτό το γαλβανικό στοιχείο είναι Ε = 1,1 V. Αν συνδέσουμε ανάστροφα μια εξωτερική πηγή με Εεξ. > 1,1 V, τότε θα υπερισχύσει το ηλεκτρικό ρεύμα που καθορίζεται από την εξωτερική πηγή. Αντιστρέφεται δηλαδή η ροή των ηλεκτρονίων, και αυτό έχει ως αποτέλεσμα στα δύο ηλεκτρόδια να συμβεί το αντίστροφο φαινόμενο.

Σύνδεση εξωτερικής πηγής ανάστροφα σε γαλβανικό στοιχείο
Στο παραπάνω σχήμα φαίνεται το ρεύμα που παράγεται από το γαλβανικό στοιχείο του Daniell (δεξιόστροφο) αλλά και ο ρόλος των ηλεκτροδίων (το ηλεκτρόδιο του Zn αποτελεί την άνοδο και το ηλεκτρόδιο του Cu αποτελεί την κάθοδο). Συνδέθηκε ανάστροφα εξωτερική πηγή με Εεξ. > 1,1 V . Παρατηρούμε ότι άλλαξε η φορά του ρεύματος που διαρρέει το κύκλωμα (αριστερόστροφο), αλλά ταυτόχρονα άλλαξε και ο ρόλος των ηλεκτροδίων στο γαλβανικό στοιχείο του Daniell. Στο καινούργιο κύκλωμα, το ηλεκτρόδιο του Zn αποτελεί την κάθοδο και το ηλεκτρόδιο του Cu αποτελεί την άνοδο.
Συγκεκριμένα στο ηλεκτρόδιο του Zn, (αντίθετα απ? ότι συμβαίνει στο στοιχείο Daniell)
τα κατιόντα Zn2+(aq) από το διάλυμα προσλαμβάνουν e- (προερχόμενα από τον αρνητικό πόλο της πηγής) και ανάγονται (ηλεκτροανάγονται) προς μεταλλικό Zn, o οποίος αποτίθεται (επικάθεται) στο ηλεκτρόδιο του Zn, το οποίο εμφανίζει αύξηση της μάζας του (χοντραίνει). Δηλαδή το ηλεκτρόδιο του Zn αποτελεί την κάθοδο, επειδή συμβαίνει αναγωγή (μειώνεται ο αριθμός οξείδωσης).
Το ηλεκτρόδιο του Cu (αντίθετα απ? ότι συμβαίνει στο γαλβανικό στοιχείο Daniell), διαβρώνεται ηλεκτροδιαλυόμενο (και λεπταίνει σιγά-σιγά) και στο διάλυμα αυξάνεται συνεχώς η συγκέντρωση των Cu2+(aq). Δηλαδή το ηλεκτρόδιο του Cu αποτελεί την άνοδο, επειδή συμβαίνει οξείδωση (αυξάνεται ο αριθμός οξείδωσης).
Με πρόσθεση κατά μέλη των δύο οξειδοαναγωγικών αντιδράσεων που πραγματοποιούνται στα δύο ηλεκτρόδια προκύπτει η συνολική αντίδραση που πραγματοποιείται:
Πρόκειται για μια μη αυθόρμητη οξειδοαναγωγική αντίδραση (σύμφωνα με τον πίνακα των κανονικών δυναμικών οξειδοαναγωγής). Ωστόσο όμως μπορεί να πραγματοποιηθεί με τη χρήση κατάλληλης εξωτερικής πηγής και τη μετατροπή της ηλεκτρικής ενέργειας σε χημική. Με αυτό τον τρόπο έχουμε κατασκευάσει ένα ηλεκτρολυτικό στοιχείο.
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 6.1 ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΣΤΟΙΧΕΙΑ | 6.3 Η ΔΡΑΣΗ ΣΤΑ ΗΛΕΚΤΡΟΔΙΑ |