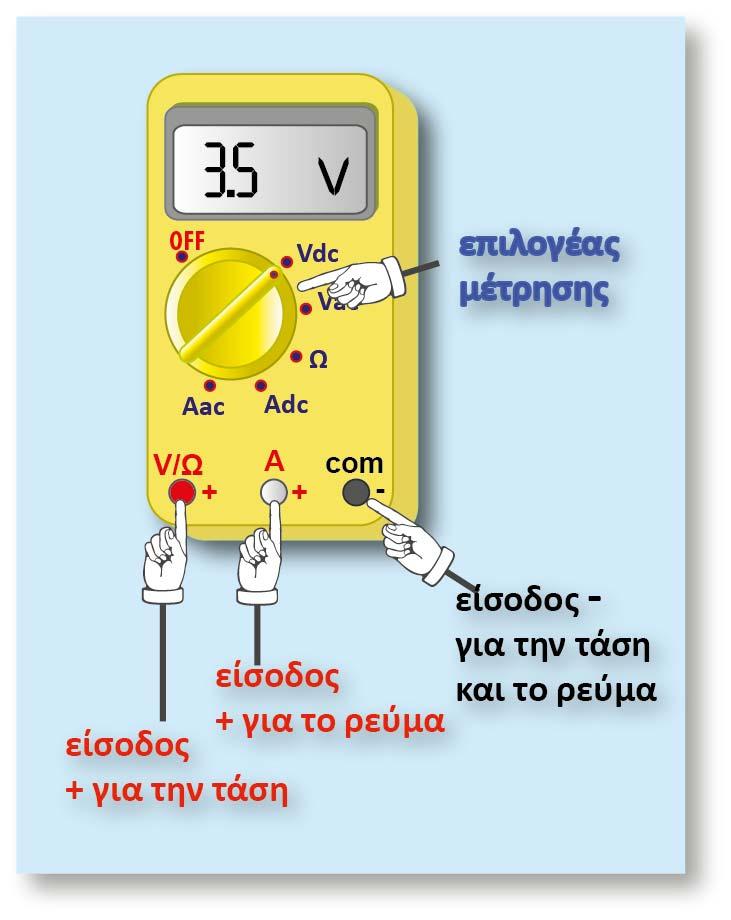
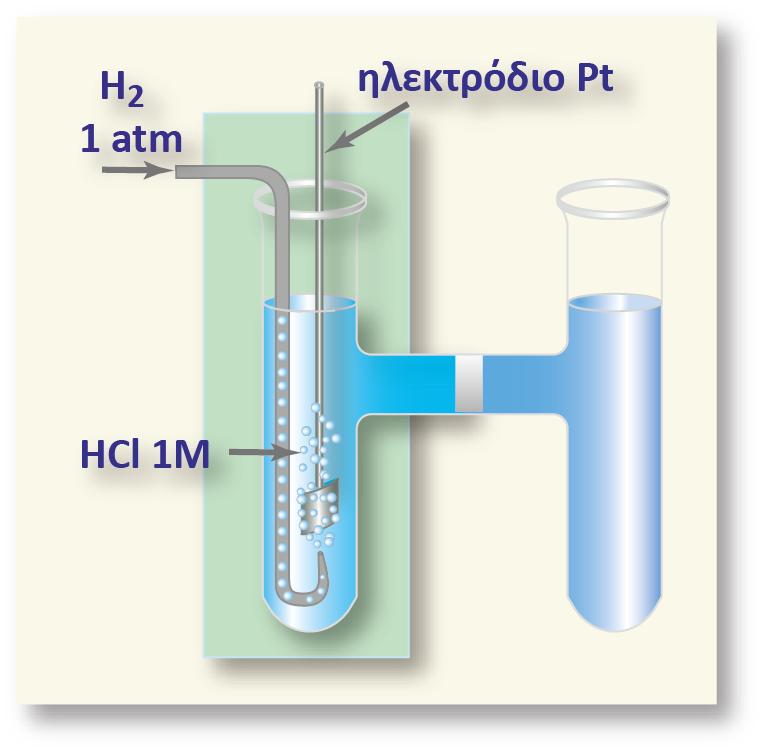
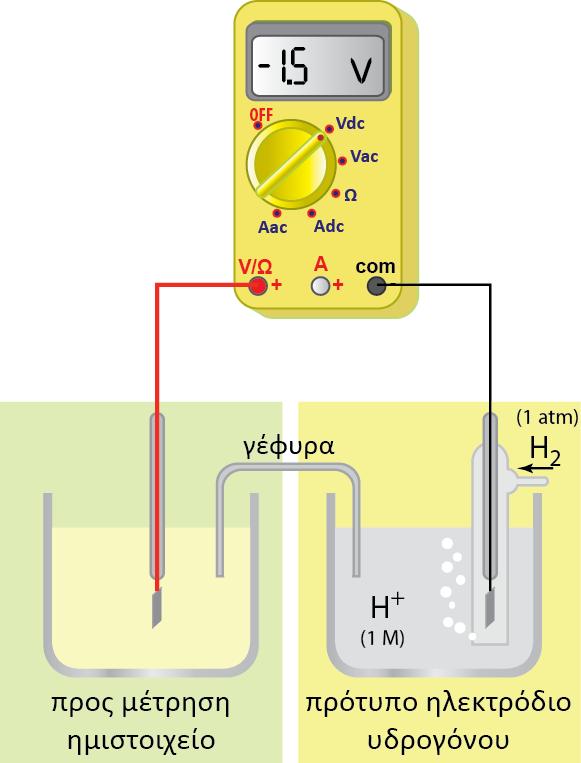
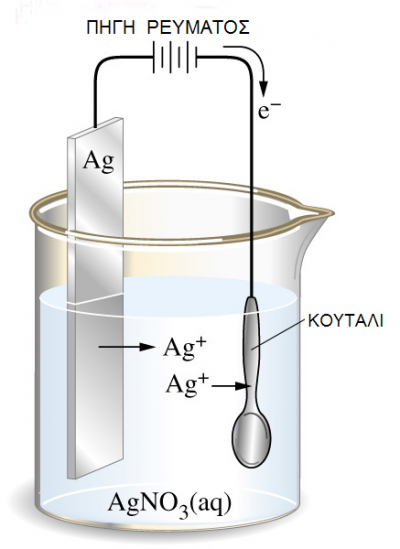
1.2 ΙΣΟΡΡΟΠΙΑ REDOX ΜΕΤΑΛΛΟΥ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 1. ΗΛΕΚΤΡΟΔΙΑΛΥΤΙΚΗ ΤΑΣΗ > 1.2 ΙΣΟΡΡΟΠΙΑ REDOX ΜΕΤΑΛΛΟΥ
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 1.1 ΗΛΕΚΤΡΟΔΙΑΛΥΤΙΚΗ ΤΑΣΗ |
1.3 ΕΡΜΗΝΕΙΑ ΗΛΕΚΤΡΟΔ/ΚΗΣ ΤΑΣΗΣ |
Η ισορροπία ανάμεσα στην οξειδωμένη (Οx) και αναγμένη (Red) μορφή του μετάλλου

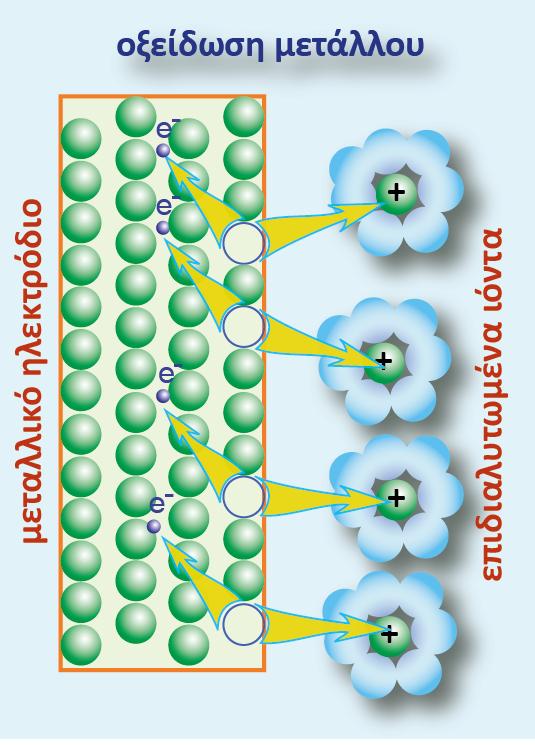
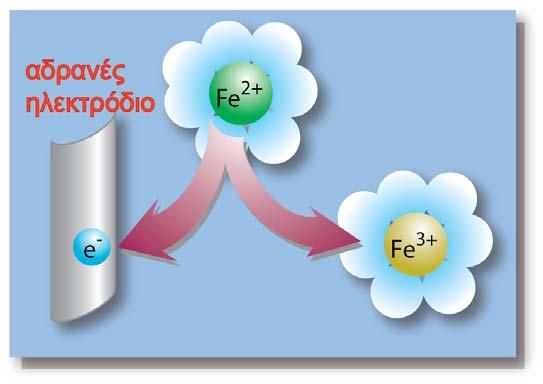
Ας μελετήσουμε την ημιαντίδραση η οποία περιγράφει την ηλεκτροδιαλυτική τάση του μετάλλου M:
![]()
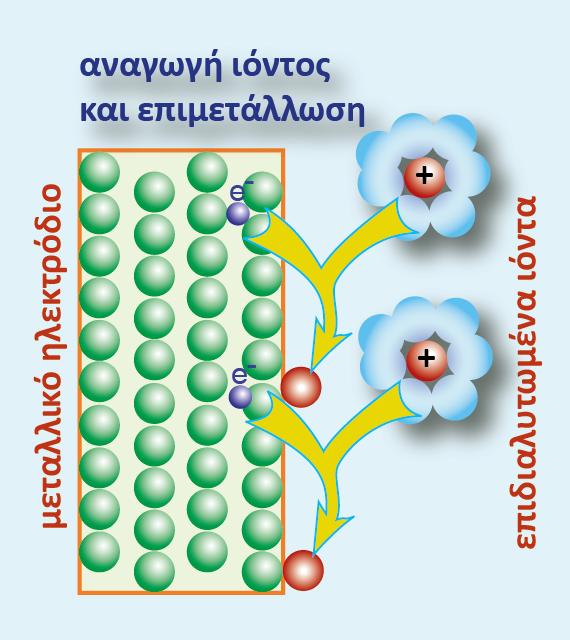
Η αντίδραση αυτή, όπως είναι γραμμένη και διαβάζοντάς την από αριστερά προς τα δεξιά, είναι μια ημιαντίδραση οξείδωσης. Το αριστερό μέλος της ημιαντίδρασης της ηλεκτροδιαλυτικής τάσης του μετάλλου, περιγράφει τη μία από τις δύο καταστάσεις του μετάλλου, δηλαδή τη μεταλλική του κατάσταση, Μ(s). Η κατάσταση αυτή αποτελεί την αναγμένη κατάσταση (Red) του μετάλλου Μ.
Γι? αυτή πρέπει να γνωρίζουμε ότι τα άτομα του μετάλλου Μ βρίσκονται μέσα στο μεταλλικό πλέγμα.
Ορισμένα από αυτά (λόγω της φύσης του μεταλλικού δεσμού) έχουν χάσει ηλεκτρόνια σθένους και μέσα στο μεταλλικό πλέγμα έχει σχηματιστεί ένα «νέφος» ηλεκτρονίων, μη εντοπισμένων σε συγκεκριμένα άτομα, γνωστά ως ηλεκτρόνια αγωγιμότητας. Στο δεξιό μέλος της ημιαντίδρασης, απεικονίζεται η δυνατότητα του μετάλλου Μ να υπάρξει σε μια άλλη ενεργειακή κατάσταση (Μn+), όταν βρεθεί μέσα σε ένα ηλεκτρολυτικό περιβάλλον. Σταθεροποιείται ως επιδιαλυτωμένο κατιόν και αποτελεί την οξειδωμένη κατάσταση (Ox) του μετάλλου.
Τα ηλεκτρόνια που εμφανίζονται στο δεξιό μέλος της ημιαντίδρασης δε βρίσκονται μέσα στο διάλυμα, αλλά παραμένουν (ως περίσσεια φορτίου) μέσα στο μεταλλικό πλέγμα.
Καταλήγοντας μπορούμε να συνοψίσουμε ότι:
1. Η ηλεκτροδιαλυτική τάση είναι μία ημιαντίδραση που γίνεται, γιατί με τη βύθιση του μετάλλου στο νερό πρέπει να συνυπάρχουν σε κάποιο βαθμό (όπως σε κάθε ισορροπία) τόσο η αναγμένη μεταλλική μορφή όσο και η οξειδωμένη (κατιονική) μορφή του μετάλλου. Η παραπάνω ημιαντίδραση μπορεί να επιτευχθεί μόνο εάν τα εμπλεκόμενα στην ισορροπία ηλεκτρόνια μπορούν να υπάρξουν σε μία ενεργειακά επιτρεπτή κατάσταση μέσα σε μία «δεξαμενή ηλεκτρονίων».
2. Το ρόλο της «δεξαμενής ηλεκτρονίων» παίζει το μεταλλικό ηλεκτρόδιο, λόγω της ιδιάζουσας φύσης του μεταλλικού δεσμού που δημιουργεί το «αέριο των ελεύθερων ηλεκτρονίων» και που του επιτρέπει να παρέχει ή να δέχεται ηλεκτρόνια.
|
|||||