6.5 HΛΕΚΤΡΟΛΥΣΗ - ΓΑΛΒΑΝΟΠΛΑΣΤΙΚΗ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 6.ΗΛΕΚΤΡΟΛΥΤΙΚΑ ΣΤΟΙΧΕΙΑ > 6.5 ΗΛΕΚΤΡΟΛΥΣΗ - ΓΑΛΒΑΝΟΠΛΑΣΤΙΚΗ
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 6.4 ΣΥΓΚΡΙΣΗ ΓΑΛΒΑΝΙΚΟΥ - ΗΛΕΚΤΡΟΛΥΤΙΚΟΥ ΣΤΟΙΧΕΙΟΥ | 1 ΚΕΦΑΛΑΙΟ |
Ηλεκτρόλυση
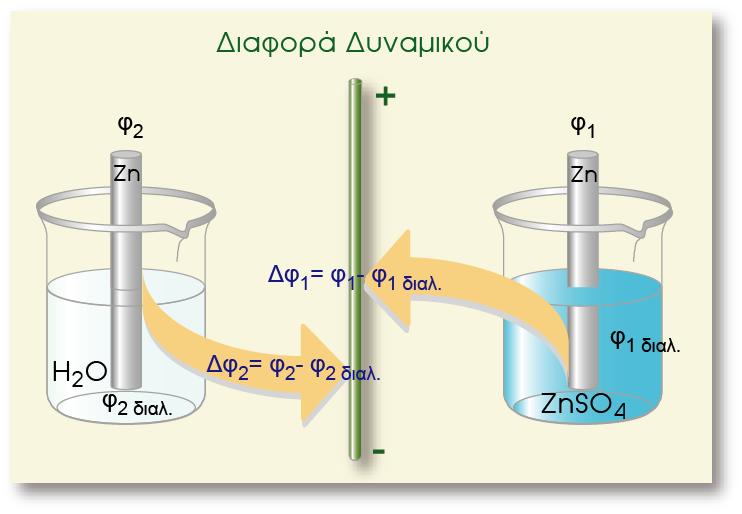
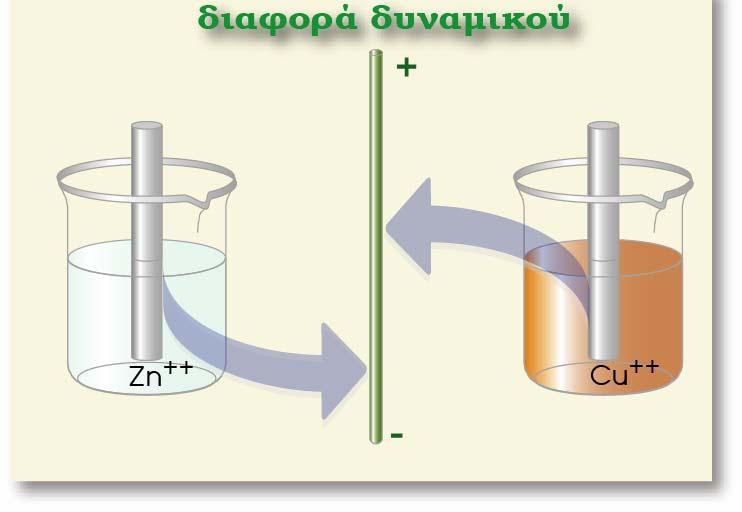
Ηλεκτρόλυση είναι το σύνολο των αντιδράσεων οξείδωσης και αναγωγής που λαμβάνουν χώρα σε ένα τήγμα ή διάλυμα ενός ηλεκτρολύτη, όταν εφαρμόσουμε κατάλληλη διαφορά δυναμικού στα άκρα των ηλεκτροδίων.
Κατά την ηλεκτρόλυση μπορούν να συμβούν τα εξής:
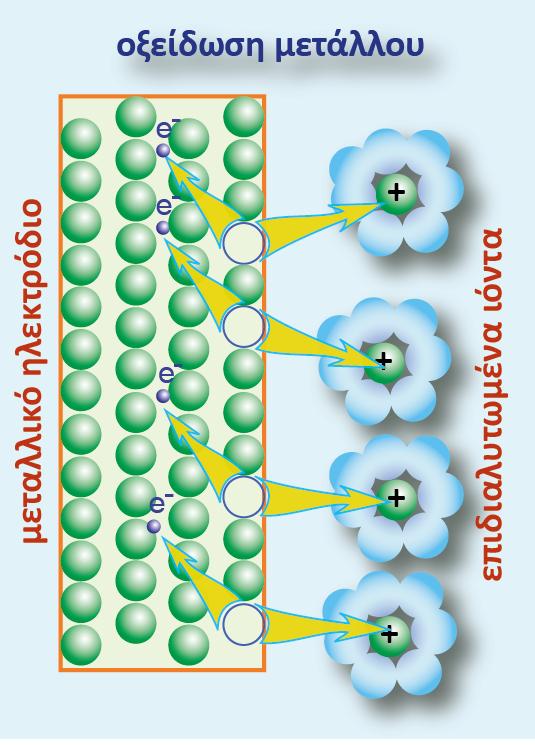
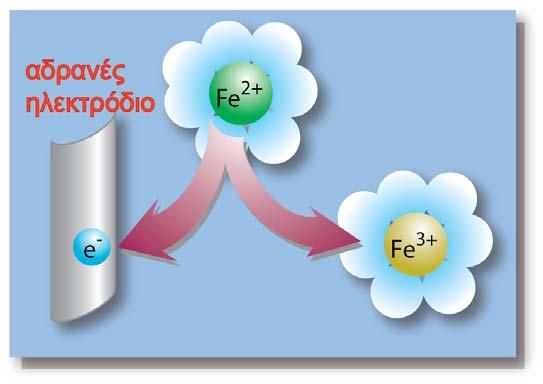
α. Ένα ιόν ή ένα μόριο σε διάλυμα μπορεί να οξειδωθεί ή να αναχθεί στο αντίστοιχο ηλεκτρόδιο.
β. Ο ίδιος ο διαλύτης (π.χ. το νερό) μπορεί να οξειδωθεί ή να αναχθεί στο αντίστοιχο ηλεκτρόδιο.
γ. Το ίδιο το μεταλλικό ηλεκτρόδιο μπορεί να οξειδωθεί ελευθερώνοντας ιόντα του μετάλλου στο διάλυμα.
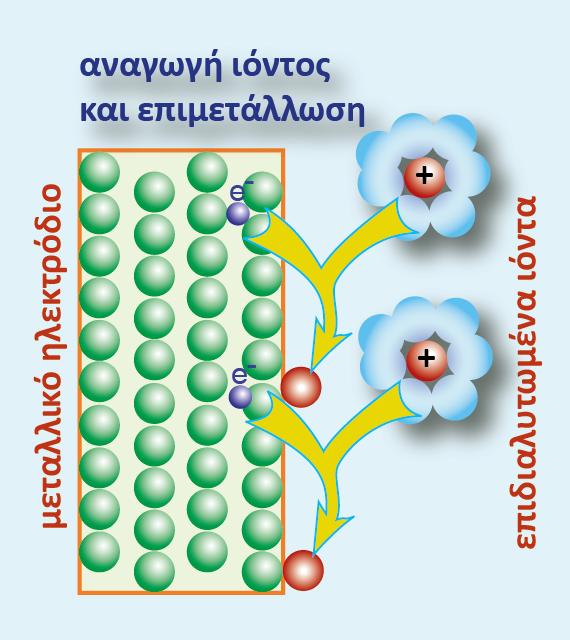
Μια σημαντική εφαρμογή της ηλεκτρόλυσης είναι η επιμετάλλωση. Στη βιομηχανία μεταλλικών αντικειμένων (μαχαιροπίρουνα, διακοσμητικά, αυτοκίνητα, κ.λ.π.) ένα αντικείμενο φτιαγμένο από ένα μέταλλο ή κράμα συχνά επικαλύπτεται από ένα στρώμα άλλου «ευγενέστερου» μετάλλου, είτε για προστασία είτε για διακόσμηση.
Μία από τις συνηθέστερες μεθόδους επιμετάλλωσης είναι με τη διαδικασία της ηλεκτρόλυσης, κατά την οποία το αντικείμενο που πρόκειται να επιμεταλλωθεί γίνεται κάθοδος και μια ποσότητα από το μέταλλο γίνεται άνοδος. Τα ηλεκτρόδια εμβαπτίζονται σε διάλυμα άλατος του ευγενούς μετάλλου και συνδέονται με πηγή συνεχούς ρεύματος.
Η επιμετάλλωση με ηλεκτρόλυση λέγεται γαλβανοπλαστική.
Η προσομοίωση σε αναδυόμενο παράθυρο
Η τεχνική της γαλβανοπλαστικής (επαργύρωση)
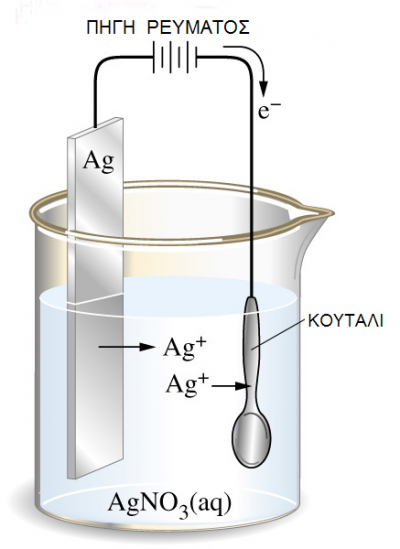
Στο παρακάτω σχήμα θέλουμε να επικαλύψουμε ένα μεταλλικό αντικείμενο
(π.χ. κουτάλι) κατασκευασμένο από Fe με ένα «ευγενέστερο» μέταλλο, π.χ.
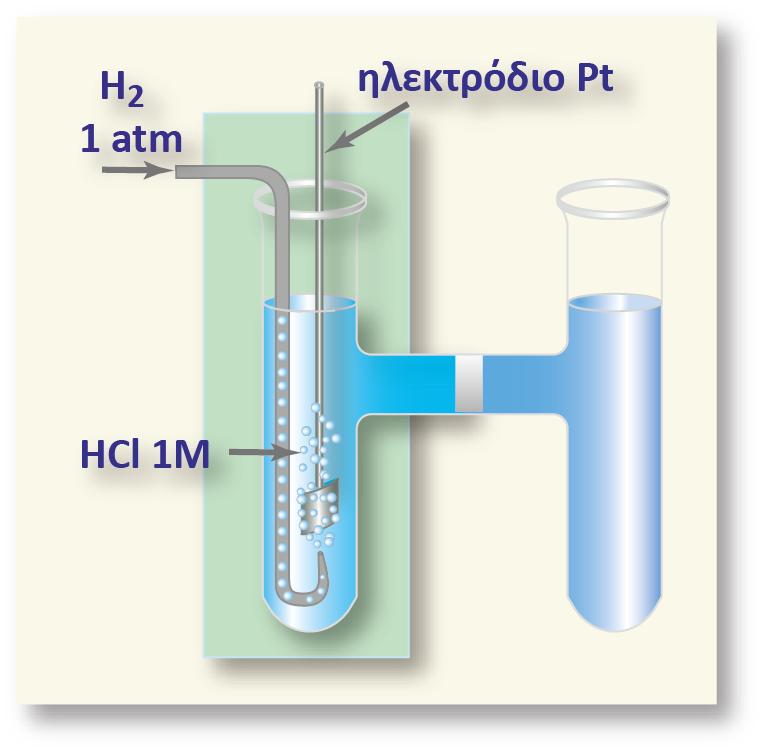
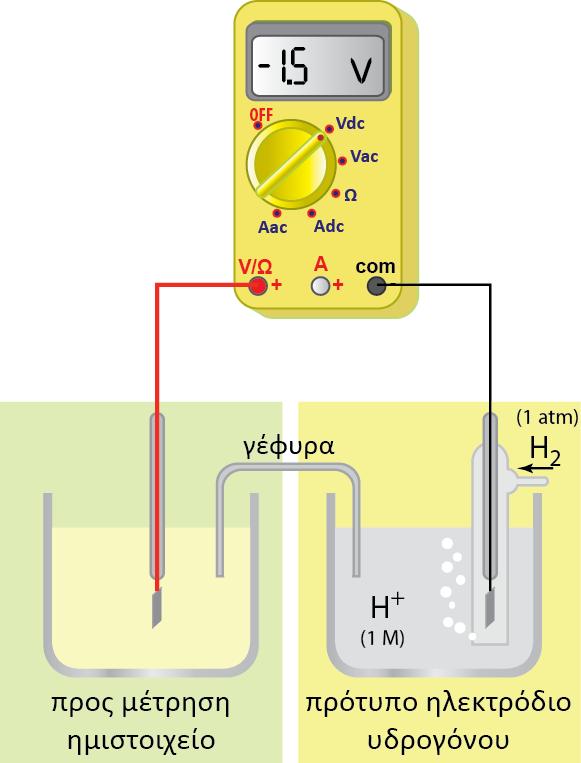
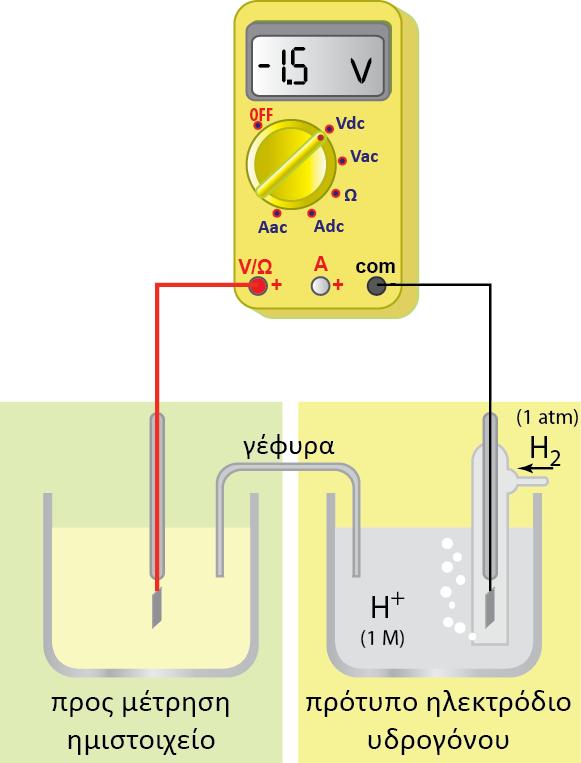
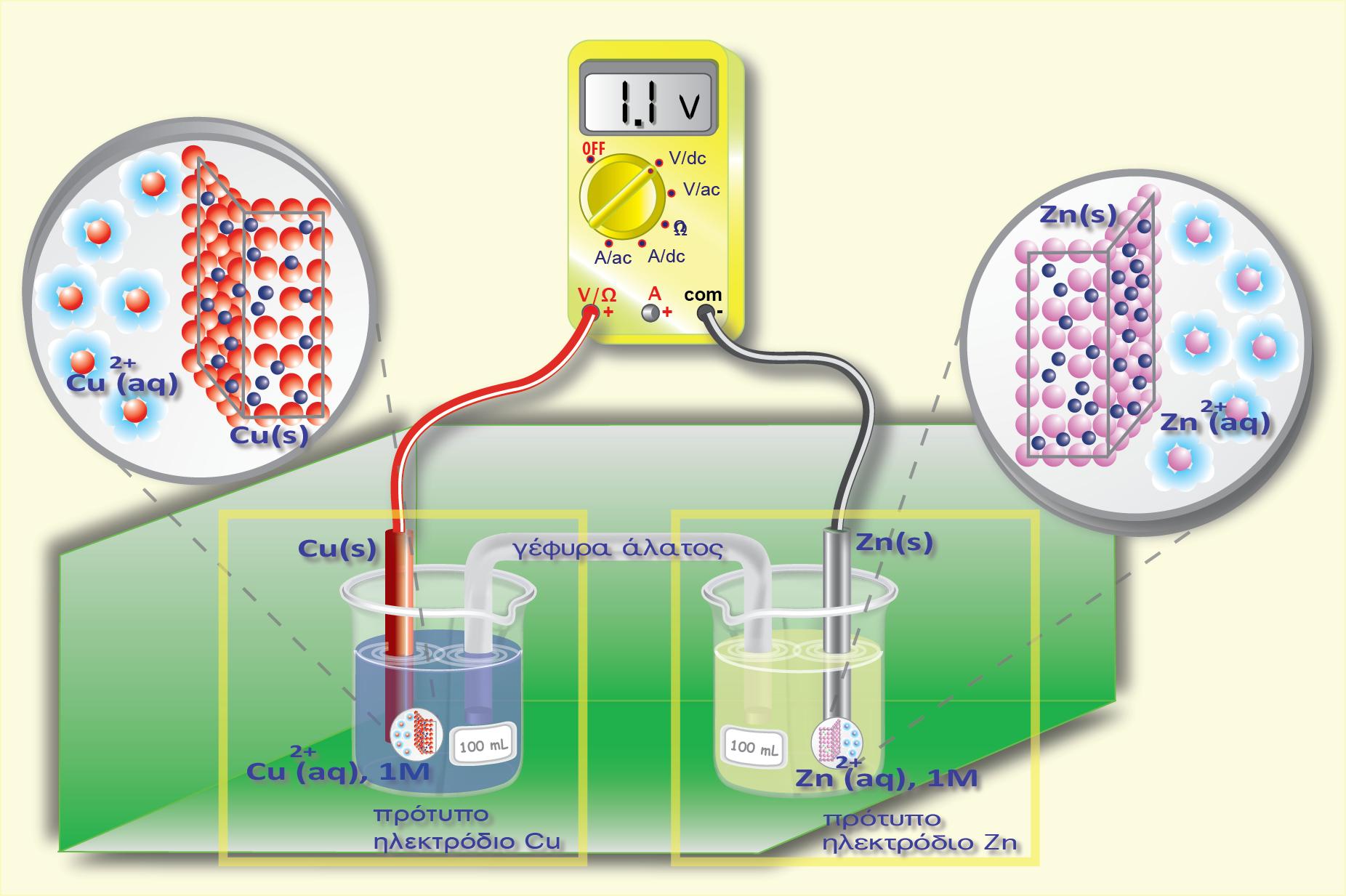
Ag. Από τους πίνακες των κανονικών δυναμικών οξειδοαναγωγής γνωρίζουμε
τις τιμές των κανονικών δυναμικών οξειδοαναγωγής για τα ημιστοιχεία
Ag(s)?Ag+(aq) και Fe(s)?Fe2+(aq) : +0,80 V και ? 0,45 V αντίστοιχα.
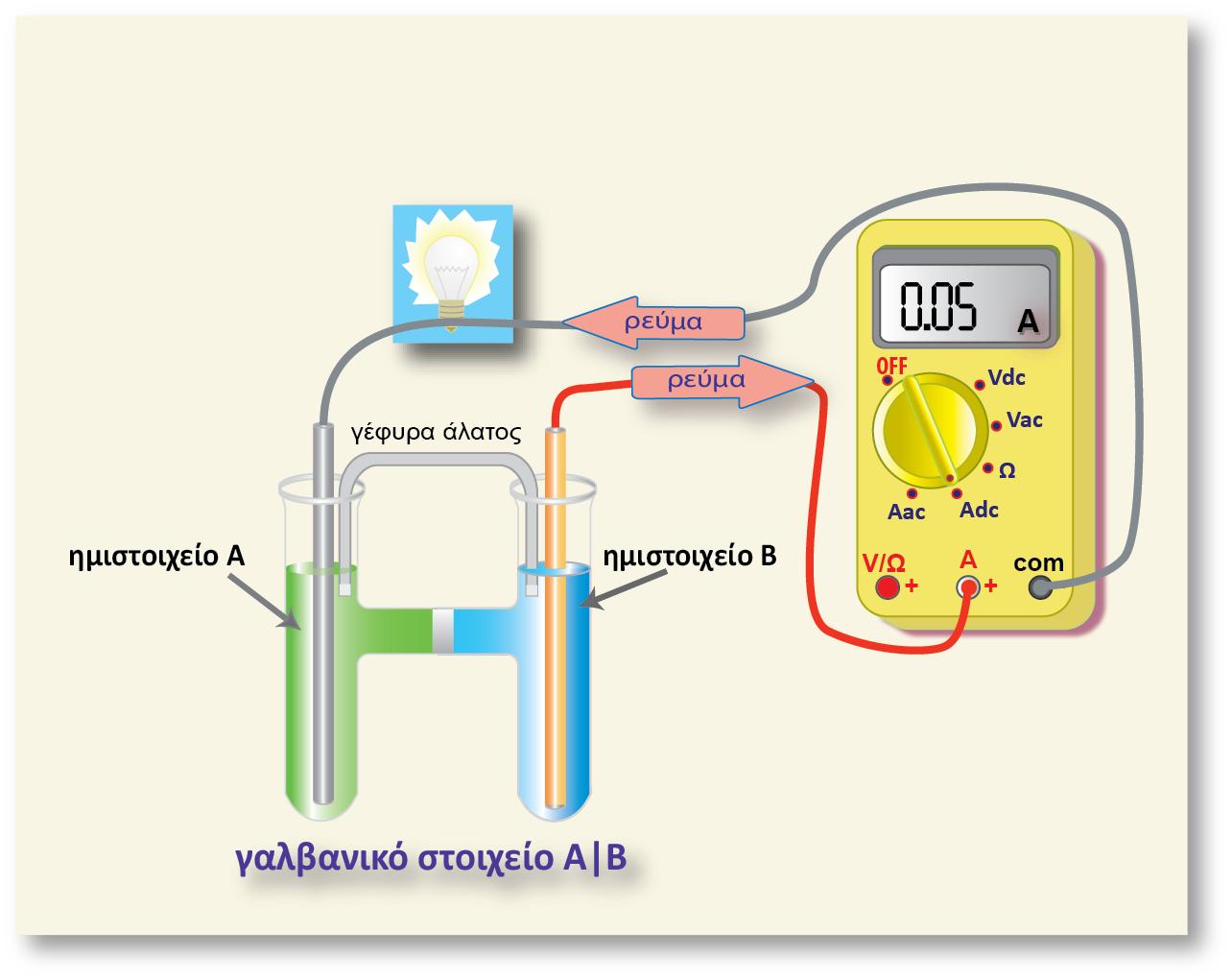
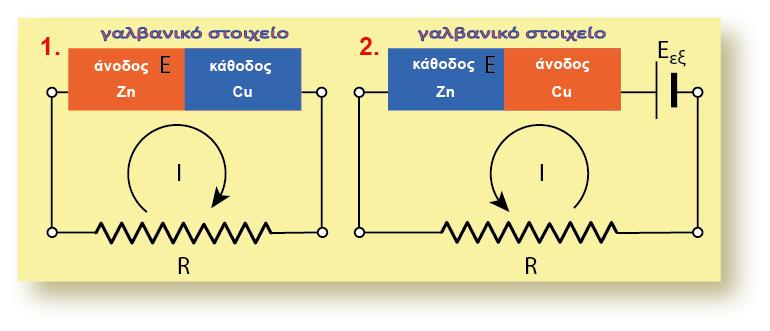
Αν συνδυάσουμε τα δύο παραπάνω ημιστοιχεία, τότε στο γαλβανικό στοιχείο
που θα προκύψει, το ηλεκτρόδιο του Fe θα αποτελεί την άνοδο, γιατί θα
πραγματοποιείται η ημιαντίδραση οξείδωσης του Fe:
και το ηλεκτρόδιο του Ag την κάθοδο (αναγωγή των ιόντων Ag+).
Γνωρίζουμε ότι μπορούμε να μετατρέψουμε το παραπάνω γαλβανικό στοιχείο
σε ηλεκτρολυτικό, με τη χρήση κατάλληλης εξωτερικής πηγής. Για να συμβεί
αυτό, θα πρέπει ισχύουν δύο προϋποθέσεις:
? επειδή η ηλεκτρεγερτική δύναμη του γαλβανικού στοιχείου έχει τιμή
η εξωτερική πηγή πρέπει να έχει ηλεκτρεγερτική δύναμη μεγαλύτερη από
αυτή, δηλαδή: Εεξ. >1,25 V
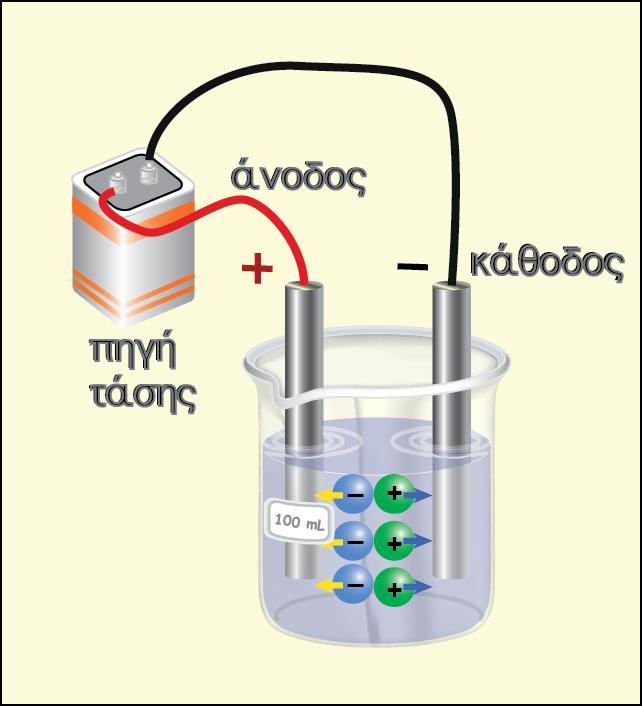
? να συνδέσουμε το θετικό πόλο της εξωτερικής πηγής με το ηλεκτρόδιο του
Ag και τον αρνητικό πόλο με το ηλεκτρόδιο του Fe.
Όπως προκύπτει από το παρακάτω σχήμα, στο ηλεκτρόδιο του Fe αλλά και
του Ag θα πραγματοποιηθούν οι αντίστροφες ημιαντιδράσεις και αυτό έχει ως
αποτέλεσμα το ηλεκτρόδιο του Fe να αποτελεί την κάθοδο και του Ag την
άνοδο.
Μέσα στο δοχείο χρησιμοποιείται διάλυμα AgNO3 . Τελικά στο ηλεκτρόδιο του
Ag (άνοδος) πραγματοποιείται ηλεκτροδιάλυση του Ag
και στην κάθοδο (ηλεκτρόδιο του Fe) γίνεται απόθεση του Ag (επαργύρωση)
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 6.4 ΣΥΓΚΡΙΣΗ ΓΑΛΒΑΝΙΚΟΥ - ΗΛΕΚΤΡΟΛΥΤΙΚΟΥ ΣΤΟΙΧΕΙΟΥ | 1 ΚΕΦΑΛΑΙΟ |