1.1 ΗΛΕΚΤΡΟΔΙΑΛΥΤΙΚΗ ΤΑΣΗ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 1. ΗΛΕΚΤΡΟΔΙΑΛΥΤΙΚΗ ΤΑΣΗ > 1.1 ΗΛΕΚΤΡΟΔΙΑΛΥΤΙΚΗ ΤΑΣΗ
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| ΒΑΣΙΚΕΣ ΓΝΩΣΕΙΣ ΗΛΕΚΤΡΙΣΜΟΥ | 1.2 ΙΣΟΡΡΟΠΙΑ REDOX ΜΕΤΑΛΛΟΥ |
Ηλεκτροδιαλυτική τάση των μετάλλων
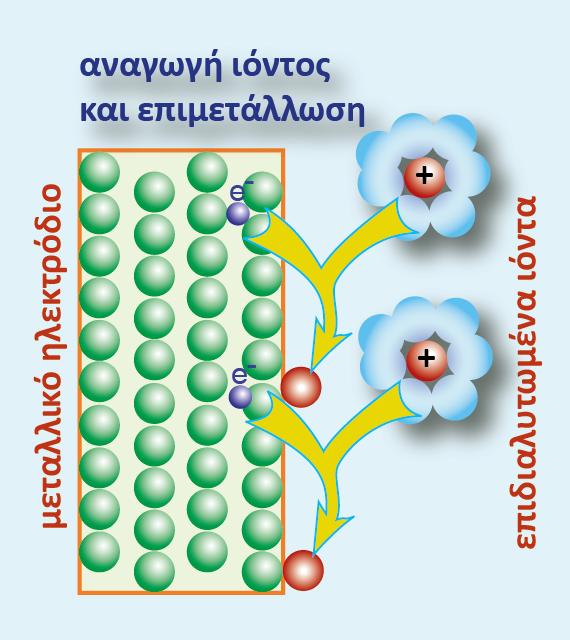
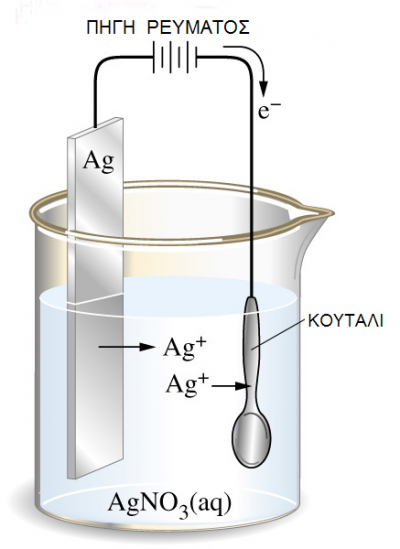
Βυθίζουμε μια ράβδο ψευδαργύρου (Zn) σε καθαρό νερό. Επειδή γνωρίζουμε ότι ο Zn απαντά στη φύση και με τη μορφή Zn2+, αυτό σημαίνει ότι άτομα Zn θα μεταφερθούν από τη ράβδο στο νερό, εγκαταλείποντας πάνω στη ράβδο τα ηλεκτρόνια της εξωτερικής τους στιβάδας.
Για κάθε άτομο Zn που απομακρύνεται από τη ράβδο και περνά στην υδατική φάση με τη μορφή
Zn2+(aq) , η ράβδος θα αποκτά περίσσεια 2 e-. Η διαδικασία αυτή της μεταφοράς Zn από τη ράβδο στην υδατική φάση, απεικονίζεται με την παρακάτω ημιαντίδραση:
![]()
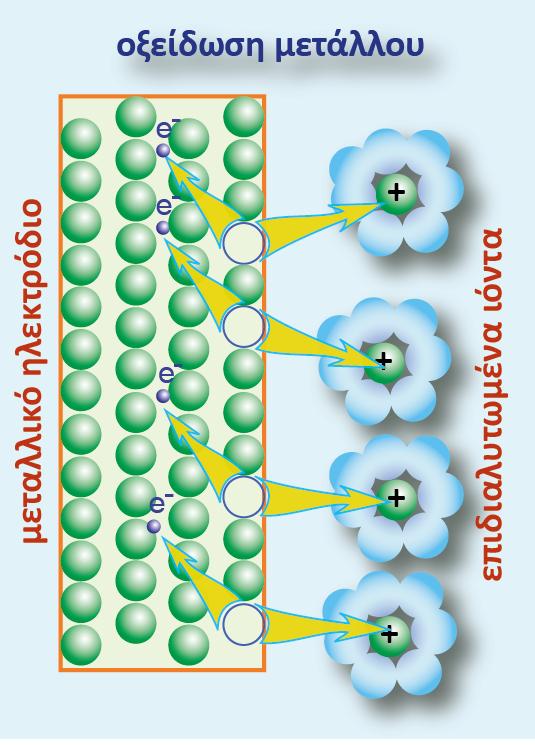
Σχήμα 1.Οξείδωση του μετάλλου και επιδιαλύτωση των ιόντων
Το φαινόμενο αυτό, παρατηρείται γενικά σε κάθε μέταλλο Μ, όταν εμβαπτισθεί σε καθαρό νερό ή σε διάλυμα άλατός του κα αποδίδεται με την παρακάτω ημιαντίδραση:
![]()
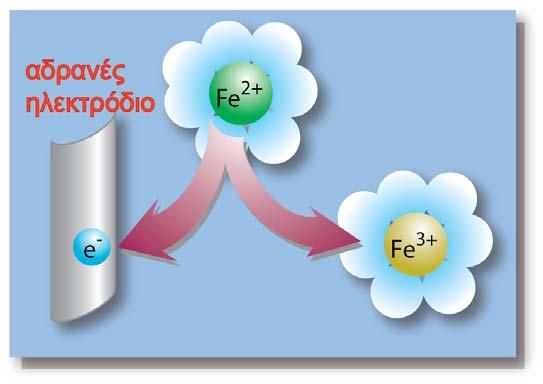
Αν το μέταλλο Μ απαντά και σε μεγαλύτερη βαθμίδα οξείδωσης, τότε πραγματοποιείται και η οξείδωση των επιδιαλυτωμένων κατιόντων, σύμφωνα με την παρακάτω ημιαντίδραση:

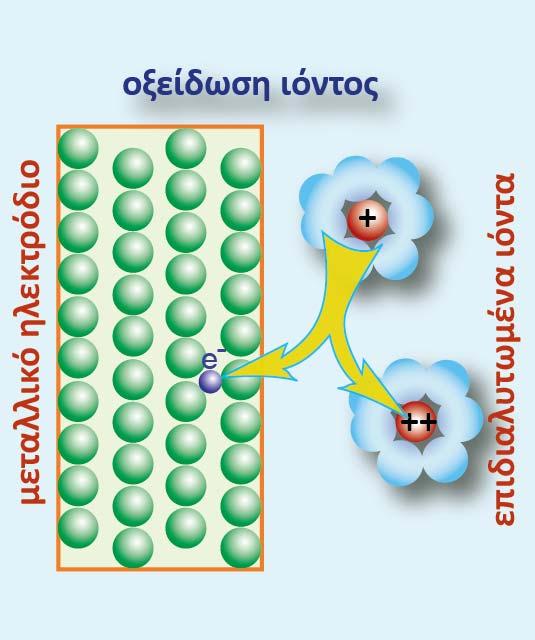
Σχήμα 2. Οξείδωση των επιδιαλυτωμένων κατιόντων
Γενικά για κάθε μέταλλο που οξειδώνεται και αποκτά φορτίο Μn+, το φαινόμενο της ηλεκτροδιάλυσης μπορεί να αποδοθεί με την ημιαντίδραση:
![]()
Η τάση αυτή που εμφανίζει κάθε μέταλλο Μ να δημιουργεί ιόντα όταν έρχεται σε επαφή με το νερό ή με διάλυμα άλατός του, ονομάζεται ηλεκτροδιαλυτική τάση.
1.2 Η αποκατάσταση της ισορροπίας της ημιαντίδρασης της ηλεκτροδιαλυτικής τάσης
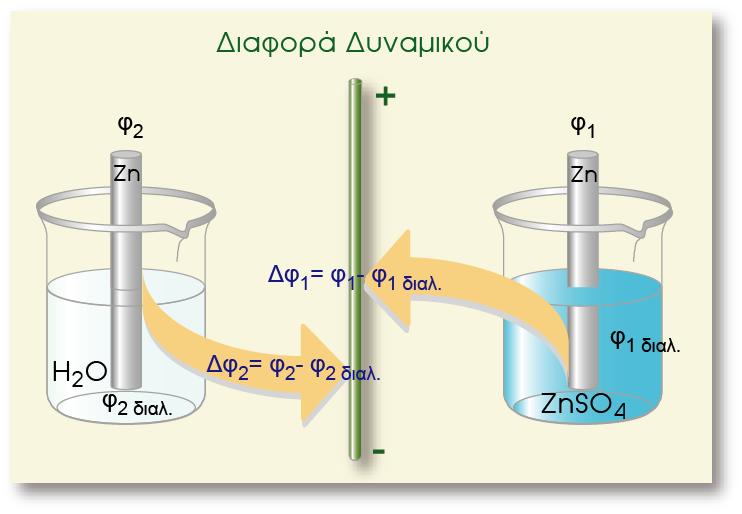
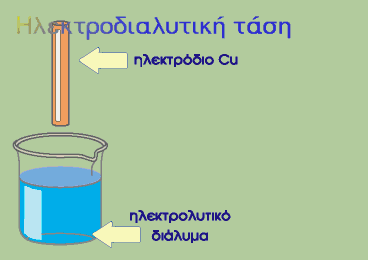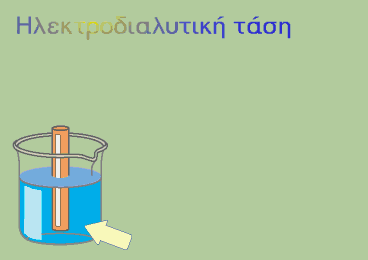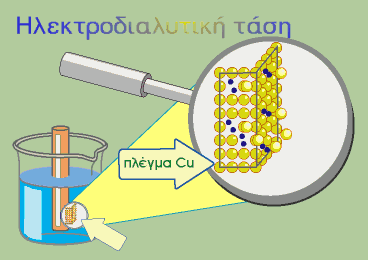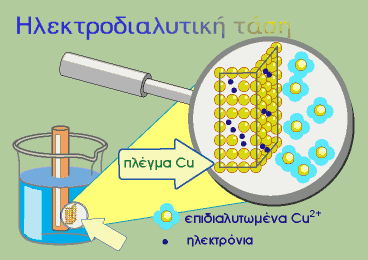
Για να μεταφερθεί ένα άτομο μετάλλου M από τη ράβδο στο διάλυμα με τη μορφή του κατιόντος του (Μn+), πρέπει να υπερνικήσει την έλξη των ηλεκτρονίων που βρίσκονται στη ράβδο καθώς και την άπωση που
αναπτύσσεται εξαιτίας των κατιόντων του διαλύματος.
Υπάρχουν δηλαδή δύο «κινητήριες» δυνάμεις στο φαινόμενο της ηλεκτροδιάλυσης:
? η «χημική» δύναμη που προκαλεί την ηλεκτροδιάλυση
? οι ηλεκτρικές δυνάμεις που αντιστέκονται στο διαχωρισμό των φορτίων
(αρνητικά-ηλεκτρόνια στο μέταλλο και θετικά-κατιόντα στο διάλυμα).
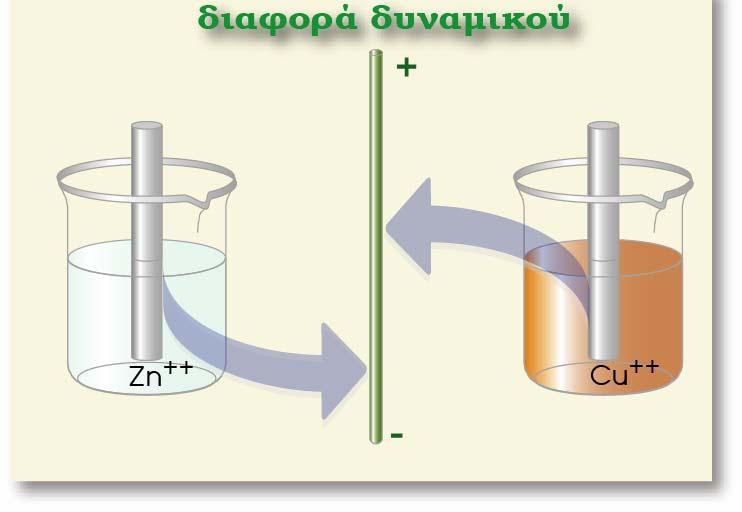
Καθώς εξελίσσεται το φαινόμενο της μεταφοράς των ατόμων του μετάλλου, η υδατική φάση φορτίζεται όλο και πιο πολύ θετικά. Έτσι βαθμιαία αρχίζει να παρεμποδίζεται η διαδικασία αυτή. Τελικά όταν η ποσότητα των κατιόντων στο διάλυμα (Μn+) και των ηλεκτρονίων στο μέταλλο αποκτήσουν κάποια τιμή, οι κινητήριες δυνάμεις εξισορροπούνται και αποκαθίσταται ισορροπία, η οποία απεικονίζεται με την παρακάτω αμφίδρομη αντίδραση:
![]()
Όταν η συγκέντρωση των ιόντων Μn+ είναι μεγάλη (γιατί έχουμε διαλύσει εκ των προτέρων στο νερό ποσότητα άλατος που περιέχει Μn+) , πραγματοποιείται και η αντίστροφη διαδικασία, δηλαδή απόθεση των κατιόντων Μn+ από την υδατική φάση στη ράβδο. Η αντίστροφη αυτή διαδικασία απεικονίζεται με την
παρακάτω ημιαντίδραση:
![]()
Ας μελετήσουμε το παράδειγμα του μετάλλου, το οποίο έχει βαθμίδες οξείδωσης +1,+2.
Αρχικά γίνεται η αναγωγή των κατιόντων Μ2+(aq) σε Μ1+(aq) σύμφωνα με το παρακάτω σχήμα:
![]()
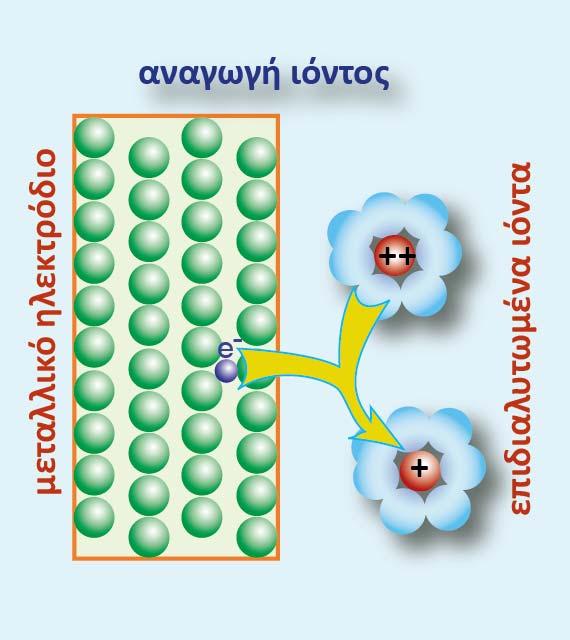
Σχήμα 3 :Αναγωγή των επιδιαλυτωμένων κατιόντων Μ2+ (aq)
Τα κατιόντα Μ1+(aq), προσλαμβάνουν από ένα e, και ανάγονται (επιμετάλλωση).
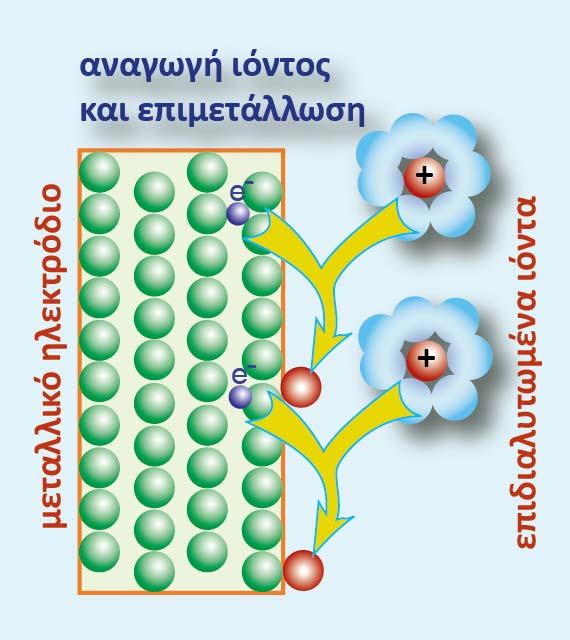
Σχήμα 4. Αναγωγή των επιδιαλυτωμένων κατιόντων Μ1+(aq)
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| ΒΑΣΙΚΕΣ ΓΝΩΣΕΙΣ ΗΛΕΚΤΡΙΣΜΟΥ | 1.2 ΙΣΟΡΡΟΠΙΑ REDOX ΜΕΤΑΛΛΟΥ |