2.5 ΣΧΕΣΗ ΔΙΑΦΟΡΑΣ ΔΥΝΑΜΙΚΟΥ - ΣΥΓΚΕΝΤΡΩΣΗΣ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 2. ΗΜΙΣΤΟΙΧΕΙΑ > 2.5 ΣΧΕΣΗ ΔV = f(C)
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 2.5 ΣΧΕΣΗ ΔΙΑΦΟΡΑΣ ΔΥΝΑΜΙΚΟΥ - ΣΥΓΚΕΝΤΡΩΣΗΣ | 2.6 ΣΧΕΣΗ ΔΥΝΑΜΙΚΟΥ ΕΝΕΡΓΟΤΗΤΑΣ e |
Εξάρτηση της διαφοράς δυναμικού από τη συγκέντρωση του κατιόντος
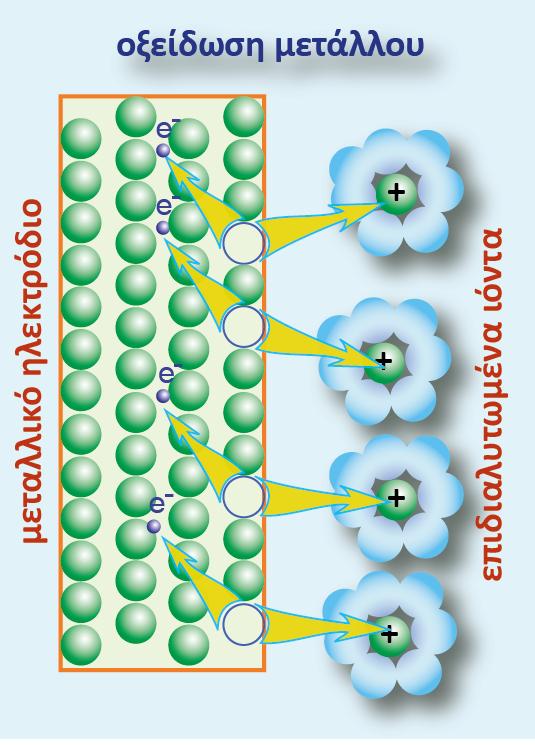
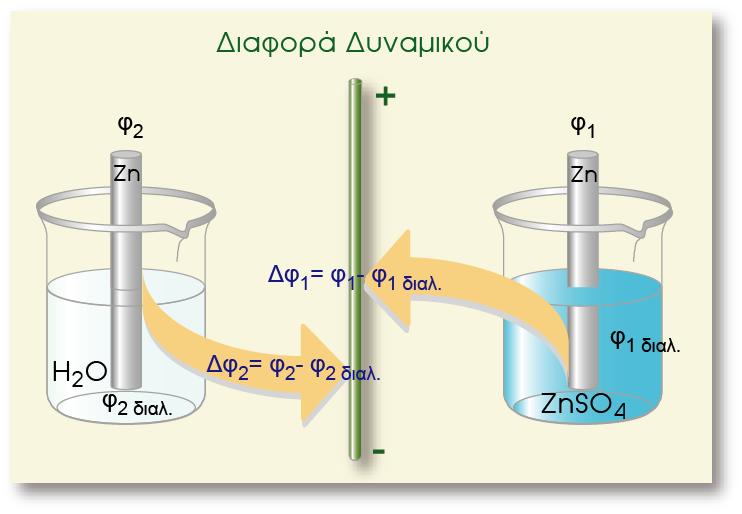
Έστω ότι βυθίζουμε μια ράβδο Zn μέσα σε καθαρό νερό, δηλαδή δημιουργούμε το ηλεκτρόδιο Zn(s)|Zn2+(aq). Όπως γνωρίζουμε στο ηλεκτρόδιο αποκαθίσταται τελικά η ισορροπία, η οποία απεικονίζεται με την παρακάτω αμφίδρομη αντίδραση και η ράβδος αποκτά κάποιο αρνητικό δυναμικό.
Τι θα συμβεί όμως αν μέσα στο νερό -στο οποίο εμβαπτίσαμε το ηλεκτρόδιο του Ζη- προσθέσουμε ένα ευδιάλυτο άλας του ψευδαργύρου (ΙΙ), όπως το ΖηSΟ4. Επειδή ο ZnSO4 είναι άλας, μέσα στο δοχείο πραγματοποιείται η παρακάτω διάσταση:
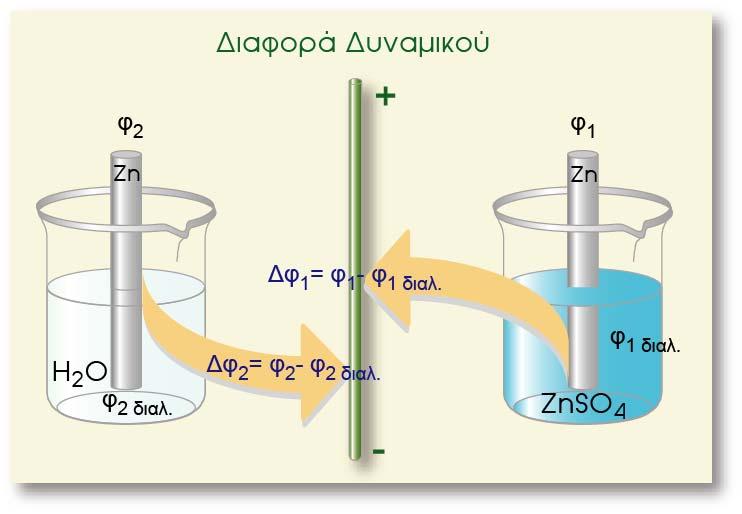
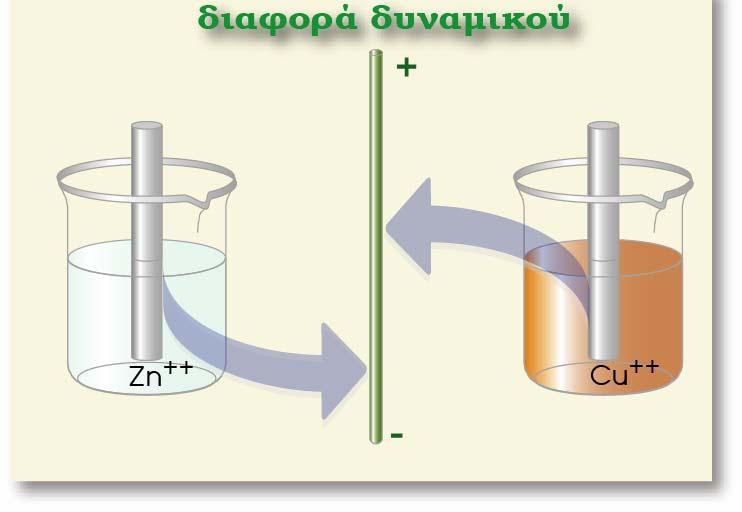
Σύγκριση δυναμικών Zn σε διαλύματα με διαφορετική συγκέντρωση
Παρατηρούμε ότι με την προσθήκη του άλατος, αυξάνεται η ποσότητα των επιδιαλυτωμένων
κατιόντων Zn2+(aq) στο διάλυμα.
Η περίπτωση αυτή παρουσιάζει άμεση αντιστοιχία με την επίδραση κοινού ιόντος της ιοντικής
ισορροπίας. Έτσι η αύξηση των κατιόντων προκαλεί μετατόπιση της ισορροπίας προς τα αριστερά (σε σχέση με ένα διάλυμα που αρχικά δεν περιείχε κατιόντα ψευδαργύρου). Κατιόντα Zn2+ προσελκύουν e (Zn2+ : e = 1 : 2) και αποτίθενται στη ράβδο. Αυτό έχει ως αποτέλεσμα να εμφανιστούν λιγότερα ηλεκτρόνια «περίσσειας» στη ράβδο σε σχέση με τα ηλεκτρόνια που υπήρχαν πριν τη διάλυση του άλατος. Επειδή η ράβδος συνεχίζει να έχει περίσσεια ηλεκτρόνιων, η διαφορά δυναμικού μεταξύ του μετάλλου και του διαλύματος θα είναι και πάλι αρνητική, αλλά θα έχει μικρότερη κατά απόλυτη τιμή (ή λιγότερο αρνητική) απ? ότι ήταν προηγουμένως.
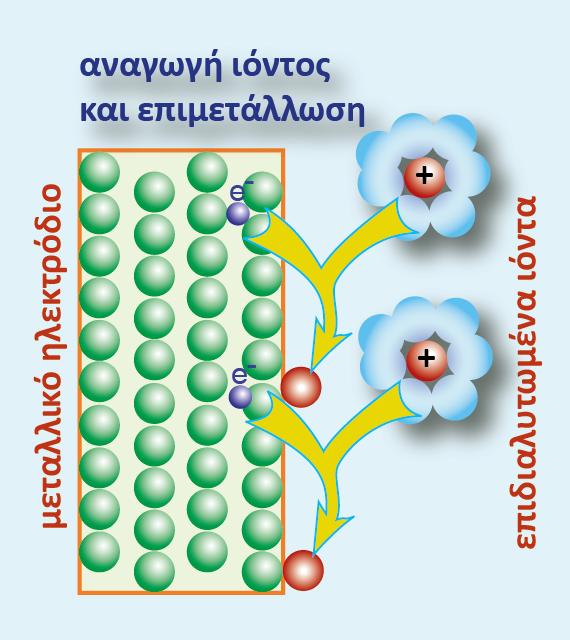
Παρατήρηση: Όταν σ? ένα μεταλλοκατιονικό ημιστοιχείο προσθέσουμε άλας του μετάλλου, αυξάνεται η ποσότητα της οξειδωμένης μορφής (Ox) και αυτό έχει ως αποτέλεσμα να αυξηθεί αλγεβρικά (ή να γίνει λιγότερο αρνητικό) το δυναμικό του.
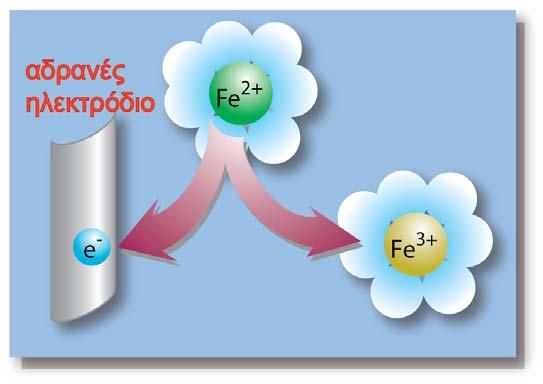
Αν γενικεύσουμε, σε κάθε ημιστοιχείο έχουμε την ισορροπία:
Όπως σε κάθε ισορροπία, έτσι στην αποκατάστασή της παραπάνω ισορροπίας, παίζουν καθοριστικό ρόλο οι συγκεντρώσεις (και επομένως οι ποσότητες) των οντοτήτων που συμμετέχουν σε αυτήν. Έτσι εκτός από τις συγκεντρώσεις των δυο μορφών Οx και Red σημαντικό ρόλο παίζει και η ποσότητα των ηλεκτρονίων.
Παρόλο που δεν έχουμε συνηθίσει να βλέπουμε συγκέντρωση ηλεκτρονίων στις σχέσεις της χημικής ισορροπίας, στην ουσία μπορούμε και στην αντίδραση της ηλεκτροδιαλυτικής τάσης να εκφράσουμε μία «σταθερά ισορροπίας» στην οποία εμπλέκεται η ποσότητα των ηλεκτρονίων, για την οποία πρέπει να ικανοποιείται η σχέση της ισορροπίας:
αRed και αOx είναι οι ενεργότητες της αναγωγικής και οξειδωτικής μορφής αντίστοιχα.
Ως ενεργότητα ηλεκτρονίων (αe-) εννοείται η «διαθέσιμη ποσότητα» ηλεκτρονίων για την αναγωγή της οξειδωτικής μορφής. Αν η μία από τις δύο ενεργότητες (ή συγκεντρώσεις) διατηρείται σταθερή (π.χ. της Red) και μεταβάλλεται η ενεργότητα της οξειδωτικής μορφής, θα πρέπει η συγκέντρωση των ηλεκτρονίων να προσαρμόζεται αντίστοιχα για την αποκατάσταση της ισορροπίας. Από τη μελέτη της σχέσης της ισορροπίας προκύπτει πως η ενεργότητα της οξειδωτικής μορφής και των ηλεκτρονίων είναι μεγέθη αντιστρόφως ανάλογα. Δηλαδή αύξηση της Ox μορφής συνεπάγεται μείωση της ποσότητας των ηλεκτρονίων (και αλγεβρική αύξηση του δυναμικού), ενώ μείωση της Ox μορφής προκαλεί αύξηση της ποσότητας των ηλεκτρονίων (και αλγεβρική ελλάτωση του δυναμικού).
Συγκεκριμένα στο μεταλλοκατιονικό ηλεκτρόδιο η αναγμένη μορφή του είναι το στερεό ηλεκτρόδιο και επομένως η ενεργότητα της Red μορφής είναι σταθερή και θεωρείται ίση με τη μονάδα
(αRed = 1) οπότε η σχέση απλοποιείται και αποκτά την απλή μορφή: αox . αe- = 1/K
Παρατήρηση: Όσο πιο μεγάλη είναι η συγκέντρωση της Ox μορφής στο διάλυμα, τόσο λιγότερα e θα υπάρχουν στην ισορροπία που επικρατεί στο ηλεκτρόδιο και τόσο πιο θετικό θα είναι το δυναμικό του.
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 2.5 ΣΧΕΣΗ ΔΙΑΦΟΡΑΣ ΔΥΝΑΜΙΚΟΥ - ΣΥΓΚΕΝΤΡΩΣΗΣ | 2.6 ΣΧΕΣΗ ΔΥΝΑΜΙΚΟΥ ΕΝΕΡΓΟΤΗΤΑΣ e |