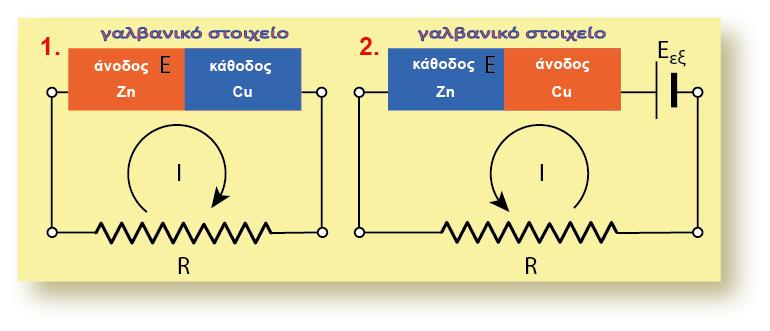
5.11 Η ΧΡΗΣΗ ΤΩΝ ΠΡΟΤΥΠΩΝ ΔΥΝΑΜΙΚΩΝ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 5.ΓΑΛΒΑΝΙΚΑ > 5.11 Η ΧΡΗΣΗ ΠΡΟΤΥΠΩΝ ΔΥΝΑΜΙΚΩΝ
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 5.10 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΣΕΙΡΑ ΜΕΤΑΛΛΩΝ | 5.12 ΕΦΑΡΜΟΓΕΣ ΓΑΛΒΑΝΙΚΩΝ ΣΤΟΙΧΕΙΩΝ |
Χρήση των πρότυπων δυναμικών στον έλεγχο πραγματοποίησης μιας χημικής αντίδρασης
Η σημασία που έχουν τα κανονικά δυναμικά στη Χημεία είναι ευρεία και δεν περιορίζεται μόνο στον καθορισμό της αντίδρασης οξειδοαναγωγής που λαμβάνει χώρα σε ένα γαλβανικό στοιχείο. Τα δυναμικά μπορούν να μας δείξουν αν θα λάβει χώρα ή όχι μία αντίδραση οξειδοαναγωγής σε ένα δοχείο αντίδρασης, όπου τα ηλεκτρόνια μπορούν να μεταφερθούν από μία ένωση σε άλλη.
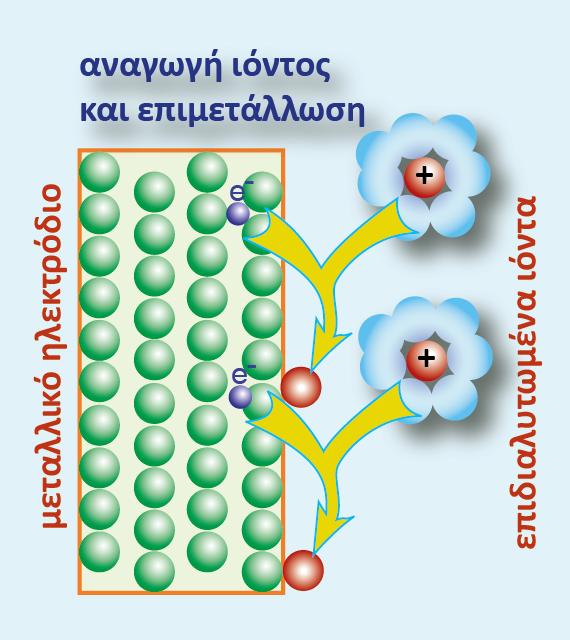
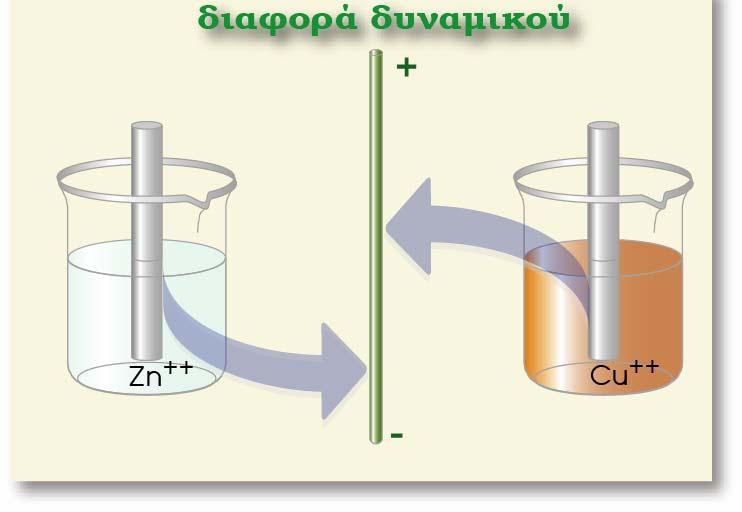
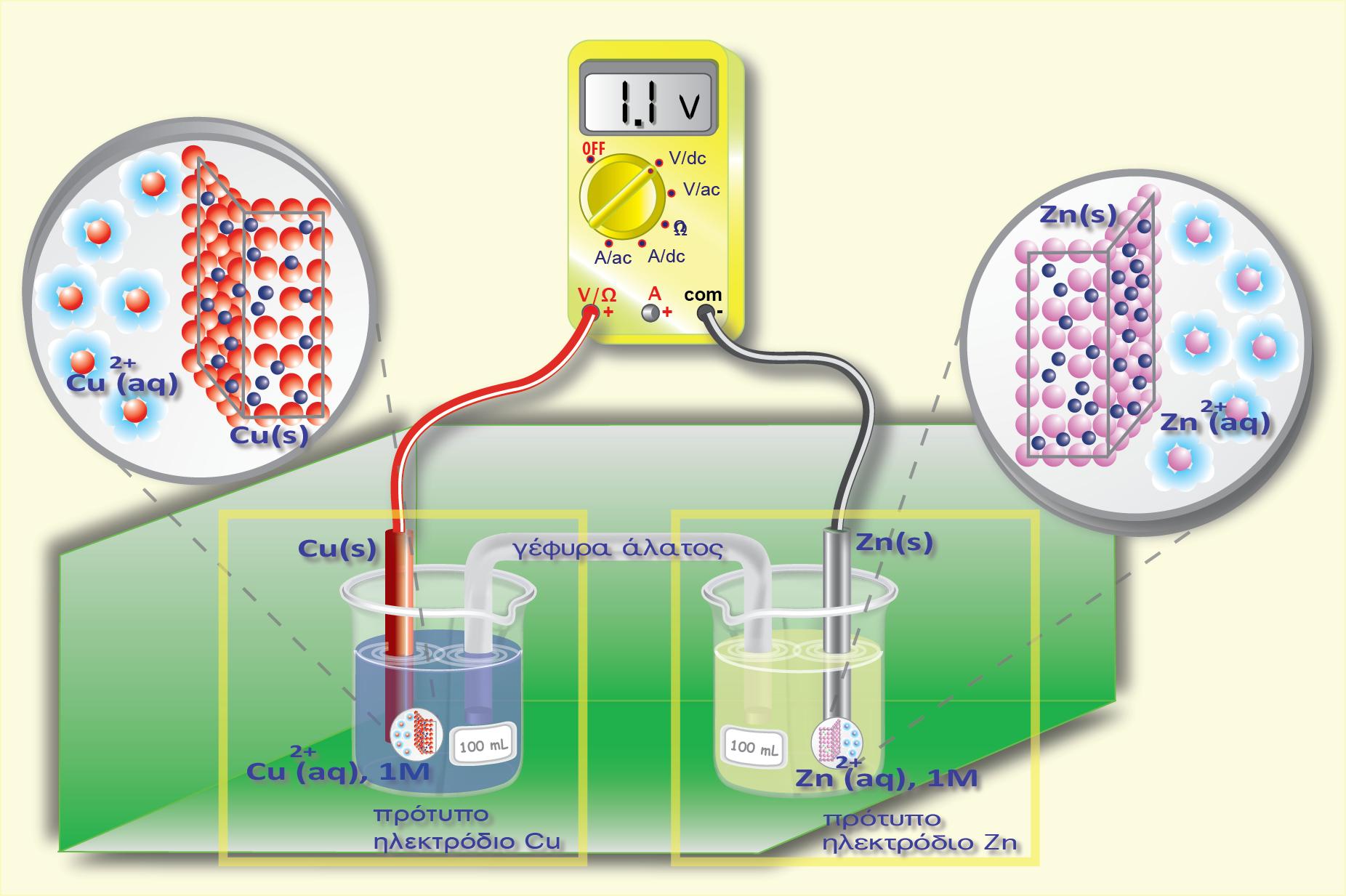
Ας θεωρήσουμε για παράδειγμα ότι τοποθετούμε ένα έλασμα Zn μέσα σε διάλυμα που περιέχει ιόντα Cu2+(CuSO4). Ας μελετήσουμε αν μπορεί να πραγματοποιηθεί κάποια αντίδραση και με ποια δεδομένα μπορούμε να το προβλέψουμε. O Zn είναι η αναγμένη μορφή του οξειδοαναγωγικού ζεύγους Ζn2+/Zn που έχει πρότυπο δυναμικό -0,76 V ενώ ο Cu2+ είναι η οξειδωμένη μορφή του οξειδοαναγωγικού ζεύγους Cu2+/Cu που έχει πρότυπο δυναμικό +0,34 V. Σύμφωνα με όσα είπαμε παραπάνω κατά τη μελέτη του στοιχείου του Daniell, ο Ζn με μικρότερη πρότυπο δυναμικό έχει τάση να οξειδωθεί ενώ ο Cu2+ να αναχθεί. Έτσι και εδώ μέσα στο διάλυμα θα λάβει χώρα η ίδια αντίδραση που γίνεται στο γαλβανικό στοιχείο.
Κατά την πραγματοποίηση της παραπάνω αντίδρασης μεταβαίνουν e- από τον Zn (αποτελεί την άνοδο - οξειδώνεται από Zn σε Zn2+) προς το Cu (αποτελεί την κάθοδο - ανάγεται από Cu2+ σε Cu). Δηλαδή τα e- θα κινηθούν από περιοχή χαμηλού (άνοδος-Zn) σε περιοχή υψηλού δυναμικού (κάθοδος- Cu). Άρα προκύπτει το συμπέρασμα ότι η παραπάνω οξειδοαναγωγική αντίδραση μπορεί να πραγματοποιηθεί αυθόρμητα.
Γενικεύοντας θα μπορούσαμε να διατυπώσουμε ότι, για να πραγματοποιηθεί αυθόρμητα μια οξειδοαναγωγική αντίδραση πρέπει για τα κανονικά δυναμικά οξειδοαναγωγής να ισχύει η παρακάτω σχέση:
Δηλαδή η διαφορά δυναμικού μεταξύ της καθόδου και της ανόδου να είναι θετικός αριθμός.
Για την παραπάνω αντίδραση πράγματι ισχύει:
Η μοναδική διαφορά από το γαλβανικό στοιχείο είναι ότι εδώ την ενέργεια που εκλύεται δεν την εκμεταλλευόμαστε, αλλά μετατρέπεται σε θερμότητα στο διάλυμα. Ο Zn ηλεκτροδιαλύεται στο διάλυμα ενώ ο χαλκός ανάγεται προς μεταλλικό Cu που καθιζάνει στον πάτο του ποτηριού, όπως φαίνεται στο παρακάτω σχήμα.

Η πραγματοποίηση της αντίδρασης οξείδωσης του Zn μέσα σε διάλυμα CuSO4 (πρώτο ποτήρι) και η μη πραγματοποίηση της αντίδρασης οξείδωσης του Cu μέσα σε διάλυμα ZnSO4 (δεύτερο ποτήρι)
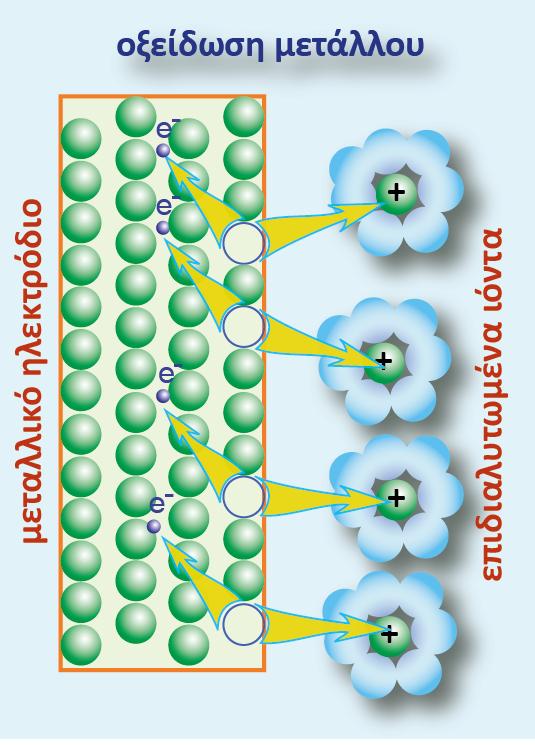
Αντίστοιχα, αν σε ποτήρι που περιέχει κατιόντα Ζn2+(ZnSO4), τοποθετήσουμε σύρμα Cu, ο Cu δεν μπορεί να οξειδωθεί ανάγοντας τον Zn, δηλαδή δε θα λάβει χώρα η παρακάτω αντίδραση:
Αν μπορούσε να πραγματοποιηθεί η παραπάνω αντίδραση, ο Cu θα αποτελούσε την άνοδο ενώ ο Zn την κάθοδο. Όπως είδαμε παραπάνω οι τιμές για τα κανονικά δυναμικά οξειδοαναγωγής είναι:
Το δυναμικό οξειδοαναγωγής του Cu (άνοδος) είναι μεγαλύτερο από αυτό του Zn (κάθοδος). Άρα δεν μπορεί να πραγματοποιηθεί η παραπάνω αντίδραση, αφού τα e- δεν μπορούν να μεταβούν από περιοχή υψηλού σε περιοχή χαμηλού δυναμικού.
Συμπέρασμα: Η αντίδραση αντικατάστασης του Cu2+ από Zn είναι μία αντίδραση οξειδοαναγωγής και η γνώση των δυναμικών μας επιτρέπει εκ των προτέρων να προβλέψουμε αν θα πραγματοποιηθεί ή όχι.
Σε αντίθεση με τον Zn , o Cu μπορεί να οξειδωθεί ανάγοντας τον Αg+ όταν έλασμα Cu τοποθετηθεί μέσα σε διάλυμα AgNO3,γιατί όπως προκύπτει από τους πίνακες πρότυπων δυναμικών, το οξειδοαναγωγικό ζεύγος Ag+/Ag έχει θετικότερο δυναμικό από το οξειδοαναγωγικό ζεύγος Cu2+/Cu.

Η πραγματοποίηση της αντίδρασης οξείδωσης του Cu μέσα σε διάλυμα AgNO3 (πρώτο ποτήρι) και η μη πραγματοποίηση της αντίδρασης οξείδωσης του Ag μέσα σε διάλυμα CuSO4 (δεύτερο ποτήρι).
Συνοψίζοντας, συμπεραίνουμε ότι τα πρότυπα δυναμικά είναι τα «ικανά και αναγκαία» δεδομένα για να προβλέψουμε αν θα πραγματοποιηθεί ή όχι μία οξειδοαναγωγική αντίδραση.
Έτσι αν τοποθετήσουμε σε ένα δοχείο αντίδρασης την οξειδωμένη μορφή μία ουσίας Α (OxA) και την αναγμένη μορφή (RedB) μιας ουσίας Β θα γίνει η αντίδραση:
μόνον εάν το πρότυπο δυναμικό του οξειδοαναγωγικού ζεύγους Α (το οποίο ανάγεται και προκαλεί την οξείδωση του Β) είναι μεγαλύτερο αλγεβρικά από το πρότυπο δυναμικό του ζεύγους Β.
Για να γίνει φυσικά αυτή η αντίδραση δεν απαιτείται η παρουσία εξαρχής στο δοχείο της αντίδρασης ούτε της RedA ούτε της OxB . Αρκούν οι δύο μορφές. Η αναγμένη μορφή του ζεύγους με το χαμηλότερο δυναμικό και η οξειδωμένη μορφή του ζεύγους με το υψηλότερο δυναμικό.
Μετά τη μελέτη πραγματοποίησης μιας οξειδοαναγωγικής αντίδρασης, μπορούμε να καταλήξουμε στα παρακάτω συμπεράσματα:
? Η αναγμένη μορφή (Red) με το χαμηλότερο δυναμικό οξειδώνεται και μπορεί να χρησιμοποιηθεί ως αναγωγικό για την αναγωγή ουσιών με υψηλότερο δυναμικό
? Η οξειδωμένη μορφή (Οx) με το υψηλότερο δυναμικό ανάγεται και μπορεί να χρησιμοποιηθεί ως οξειδωτικό για την οξείδωση ουσιών με χαμηλότερο δυναμικό.
? Όσο πιο ψηλά βρίσκεται το δυναμικό μίας ουσίας στον πίνακα των κανονικών δυναμικών - με τα θετικά (+) δυναμικά επάνω και τα αρνητικά (?) δυναμικά κάτω - τόσο πιο οξειδωτική είναι η Οx μορφή της.
? Όσο πιο χαμηλά βρίσκεται στον πίνακα αυτό μία ουσία, τόσο πιο αναγωγική είναι η Red μορφή της.
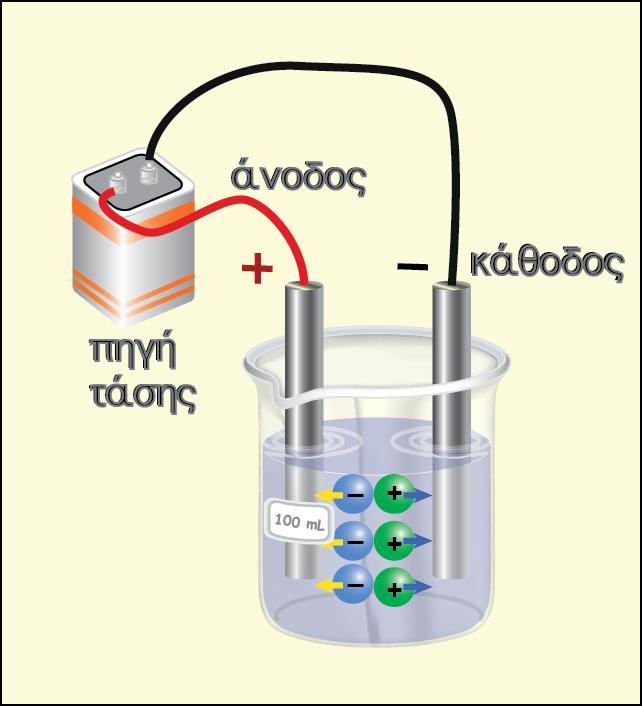
Μια από τις βασικές έννοιες του ηλεκτρισμού που πρέπει να γνωρίζουμε είναι ότι: «ένα αρνητικό ηλεκτρικό φορτίο (όπως το ηλεκτρόνιο) θα κινηθεί από περιοχή χαμηλότερου προς περιοχή υψηλότερου δυναμικού». Με βάση την αρχή αυτή και τη χρησιμοποίηση των κανονικών δυναμικών οξειδοαναγωγής (Ε0) μπορούμε να ελέγξουμε αν μια οξειδοαναγωγική αντίδραση είναι αυθόρμητη ή όχι.
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 5.10 ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΣΕΙΡΑ ΜΕΤΑΛΛΩΝ | 5.12 ΕΦΑΡΜΟΓΕΣ ΓΑΛΒΑΝΙΚΩΝ ΣΤΟΙΧΕΙΩΝ |