2.7 ΔΥΝΑΜΙΚΑ ΗΜΙΣΤΟΙΧΕΙΩΝ Cu - Zn
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 2. ΗΜΙΣΤΟΙΧΕΙΑ > 2.7 ΔΥΝΑΜΙΚΑ ΗΜΙΣΤΟΙΧΕΙΩΝ Cu - Zn
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 2.6 ΣΧΕΣΗ ΔΥΝΑΜΙΚΟΥ ΕΝΕΡΓΟΤΗΤΑΣ e |
2.8 ΓΡΑΦΗ ΑΝΤΙΔΡΑΣΗΣ ΣΤΟ ΗΜΙΣΤΟΙΧΕΙΟ |
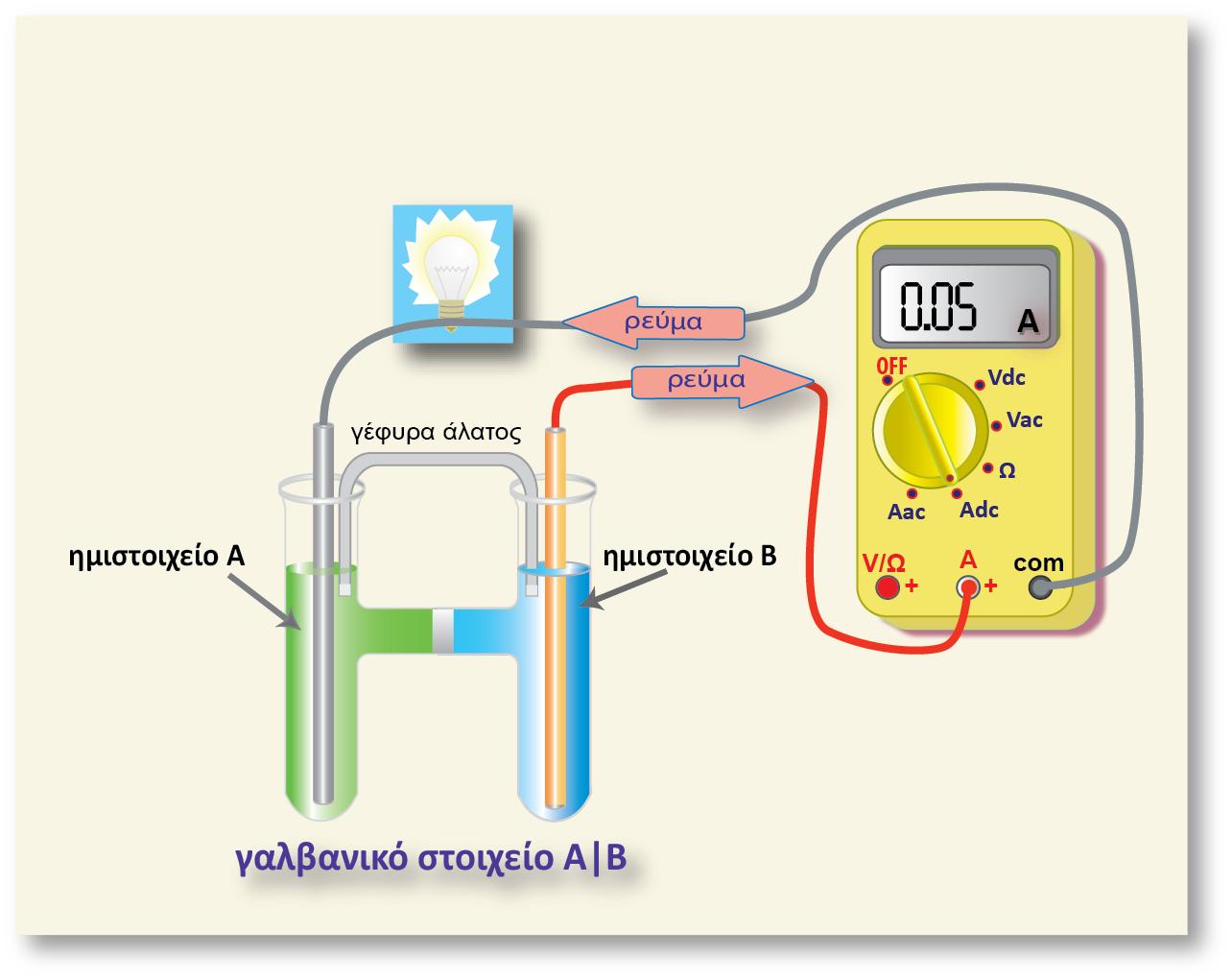
Σύγκριση του δυναμικού των ημιστοιχείων Zn και Cu
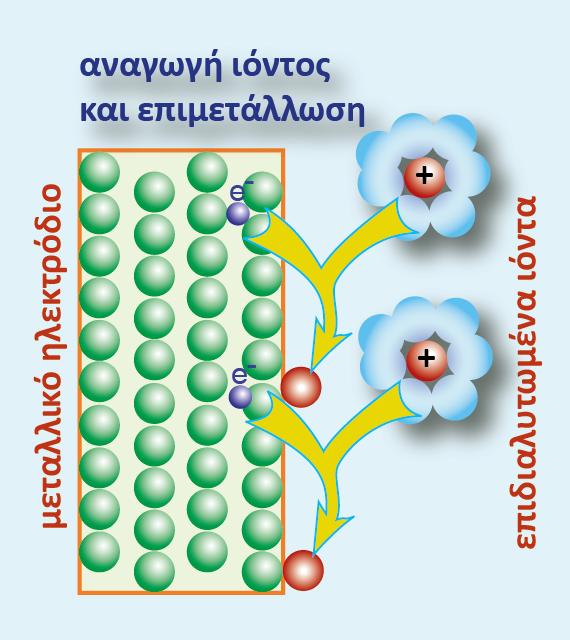
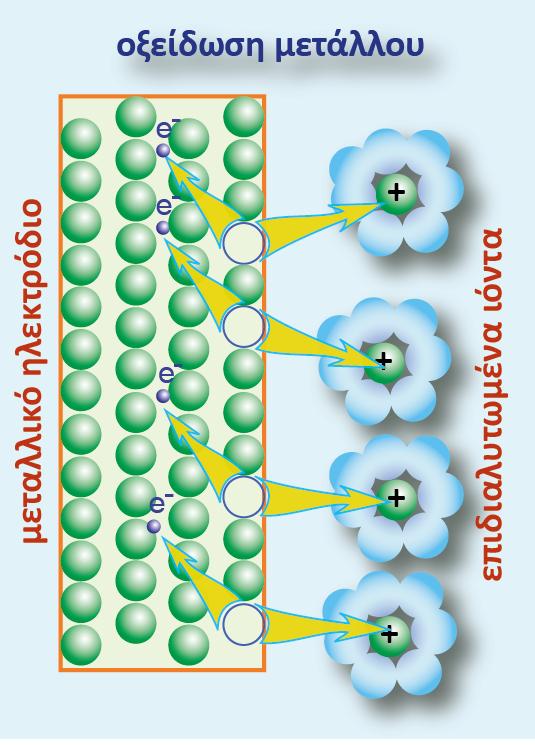
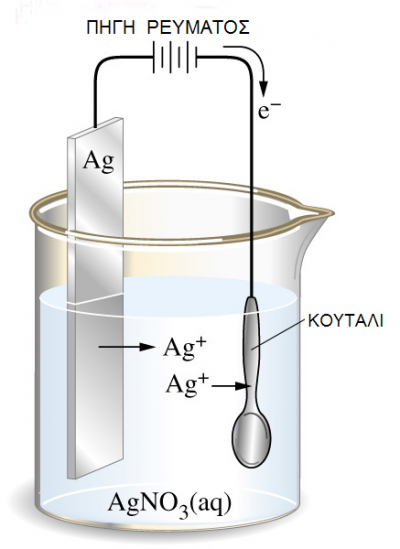
Βυθίζουμε ένα ηλεκτρόδιο ψευδαργύρου και ένα ηλεκτρόδιο χαλκού σε νερό ίδιας θερμοκρασίας. Τελικά στα δύο ηλεκτρόδια αποκαθίστανται οι παρακάτω ισορροπίες:
Αν θελήσουμε να απαντήσουμε στην ερώτηση «ποιο από τα δύο στοιχεία είναι πιο ηλεκτροθετικό», τότε το ασφαλέστερο κριτήριο είναι το δυναμικό ή πιο σωστά η διαφορά δυναμικού που αναπτύσσεται μεταξύ του ηλεκτροδίου και του νερού, γιατί όσο πιο αρνητικό είναι το δυναμικό του ηλεκτροδίου μετά την αποκατάσταση της ισορροπίας, τόσα περισσότερα ηλεκτρόνια έχουν εγκαταλειφθεί στο μέταλλο, άρα τόσο πιο πολλά κατιόντα μεταφέρθηκαν στο διάλυμα.
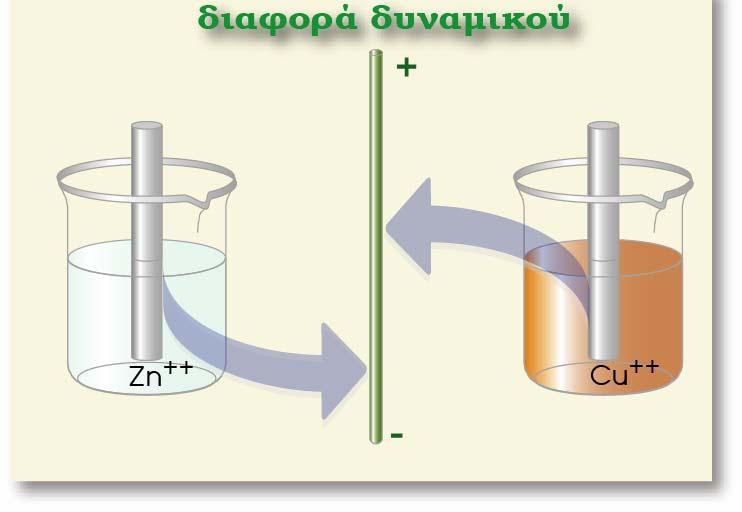
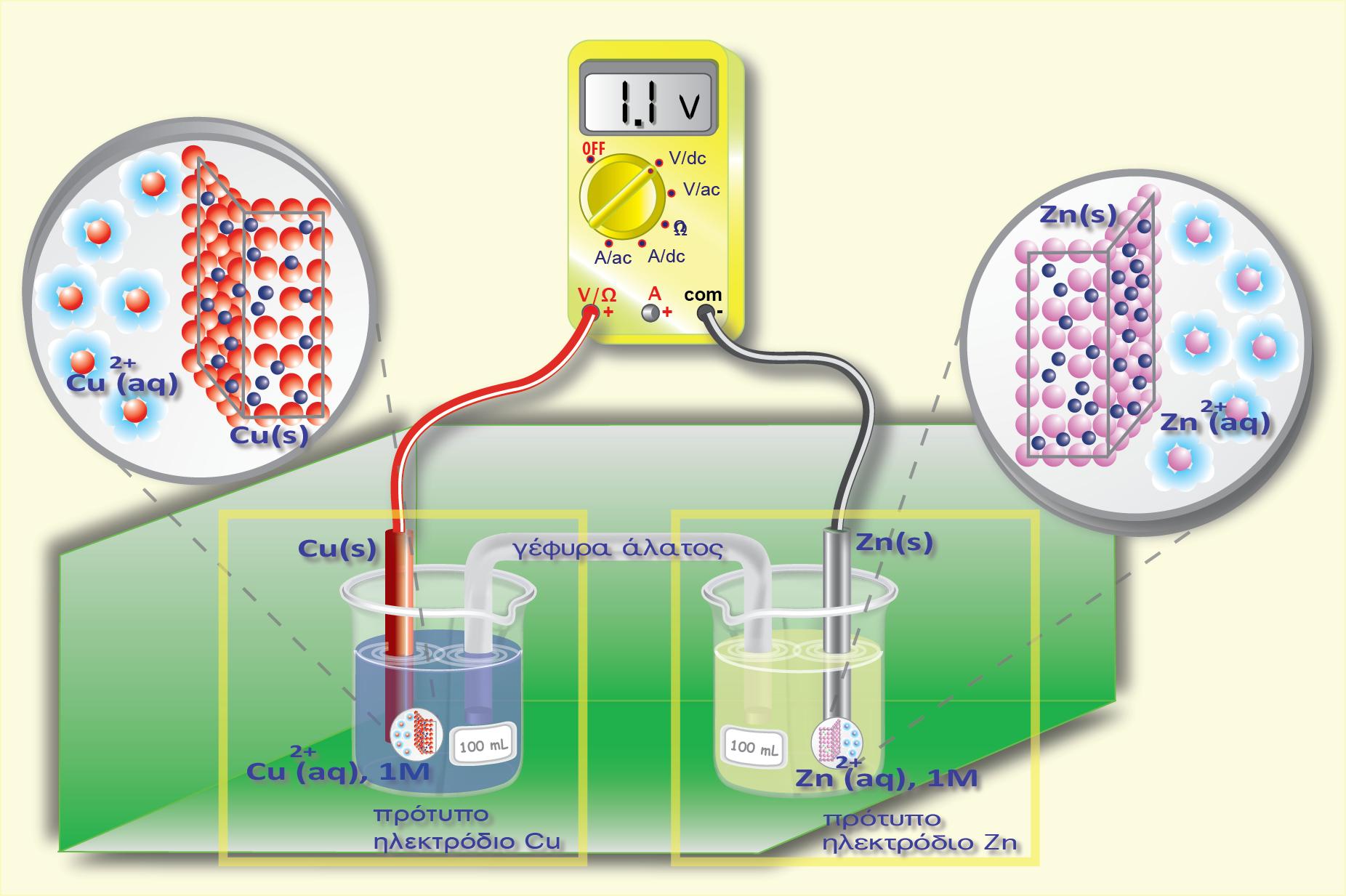
Σύγκριση του δυναμικού των ημιστοιχείων Zn και Cu
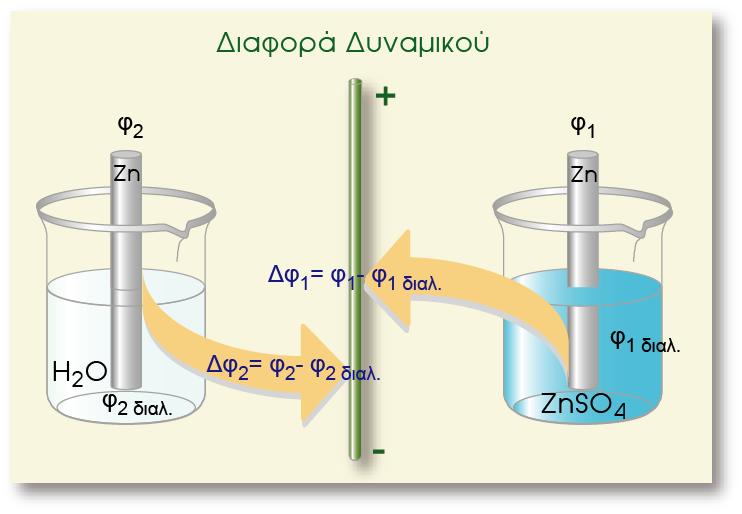
Από τα δύο αυτά μέταλλα, ο Ζη έχει μεγαλύτερη ηλεκτροδιαλυτική τάση κι έτσι η διαφορά δυναμικού του Ζη (από το διάλυμα)είναι πιο αρνητική από τη διαφορά δυναμικού του Cu (από το διάλυμα) ΔφZn = ? 9 V , ΔφCu = ? 9 V
Αν βυθίσουμε και τα δύο ηλεκτρόδια στο ίδιο διάλυμα ή αν φέρουμε με κάποιο τρόπο σε ηλεκτρική επαφή τα δύο διαλύματα (οπότε το φsol είναι κοινό) η σύγκριση διαφορών δυναμικού ανάγεται ουσιαστικά σε σύγκριση των δυναμικών των δύο μετάλλων. Δηλαδή ως προς το διάλυμα, ο Ζη
παρουσιάζει πιο αρνητικό δυναμικό απ? ότι ο Cu (όπως φαίνεται στο παραπάνω σχήμα) και το ηλεκτρόδιο του Zn έχει πιο αρνητικό δυναμικό από αυτό του Cu.
Παρατηρήσεις
1. Όσο πιο αρνητικό είναι το δυναμικό του ημιστοιχείου:
α. τόσο πιο μεγάλη είναι η ηλεκτροδιαλυτική του τάση
β. τόσο πιο ηλεκτροθετικό είναι το μέταλλο
γ. τόσο πιο μεγάλη είναι η τάση του μετάλλου να οξειδωθεί
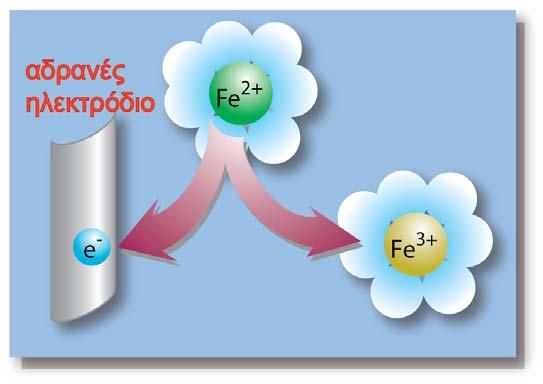
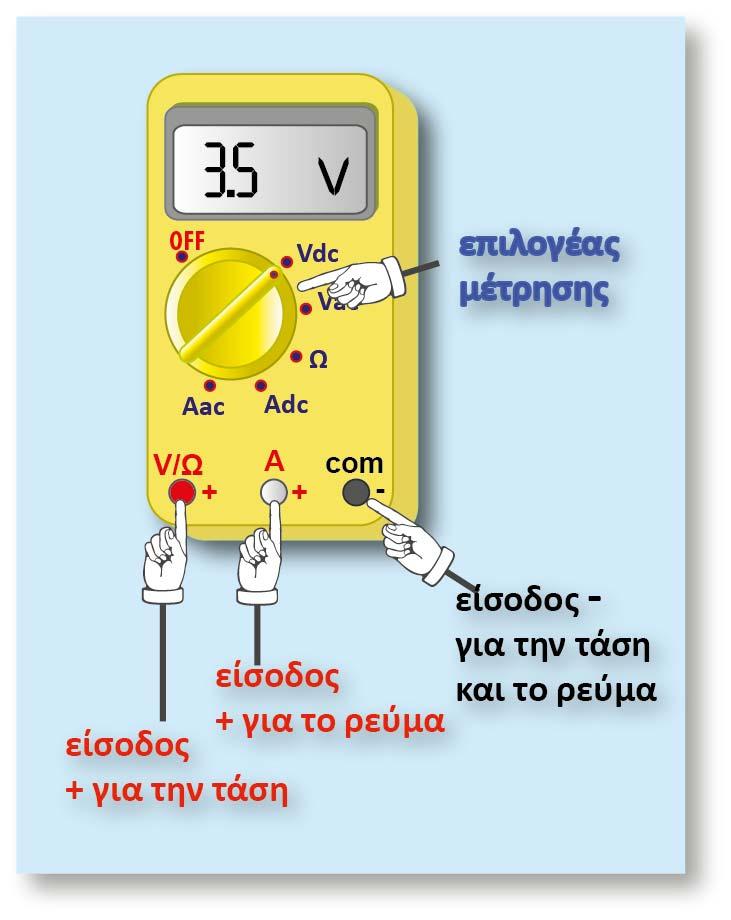
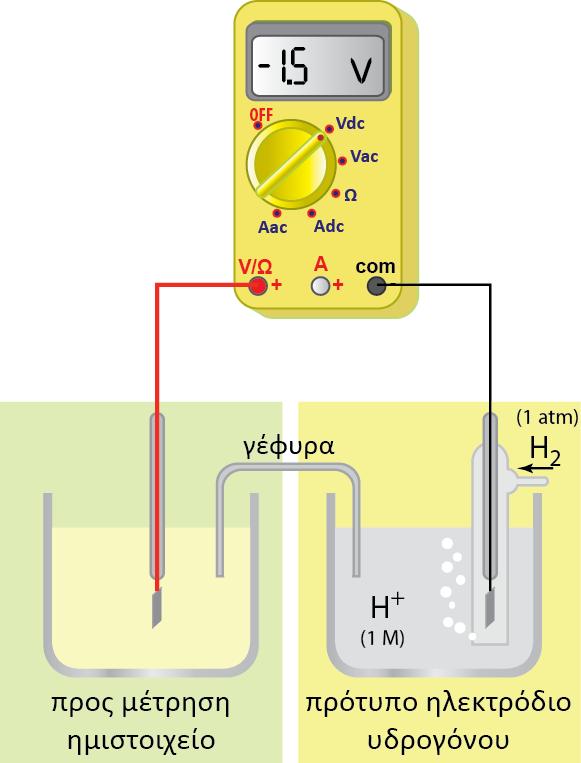
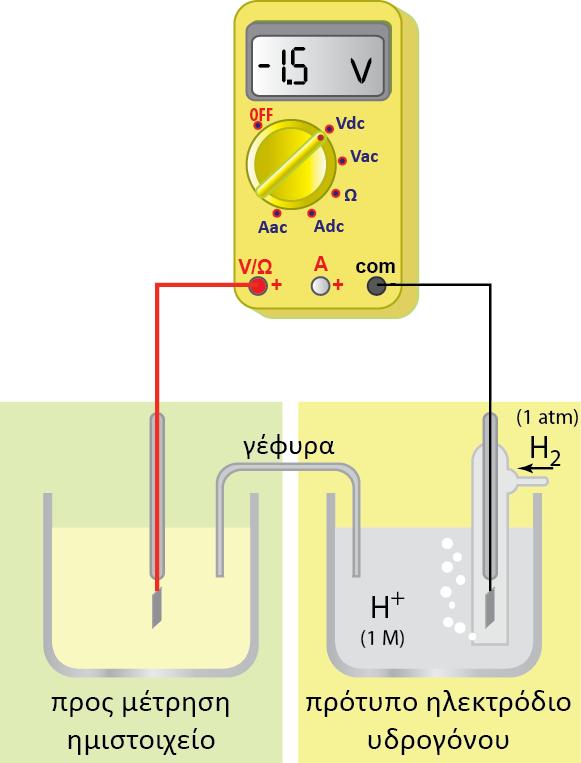
2. Το δυναμικό του ηλεκτροδίου δεν μπορεί να μετρηθεί.
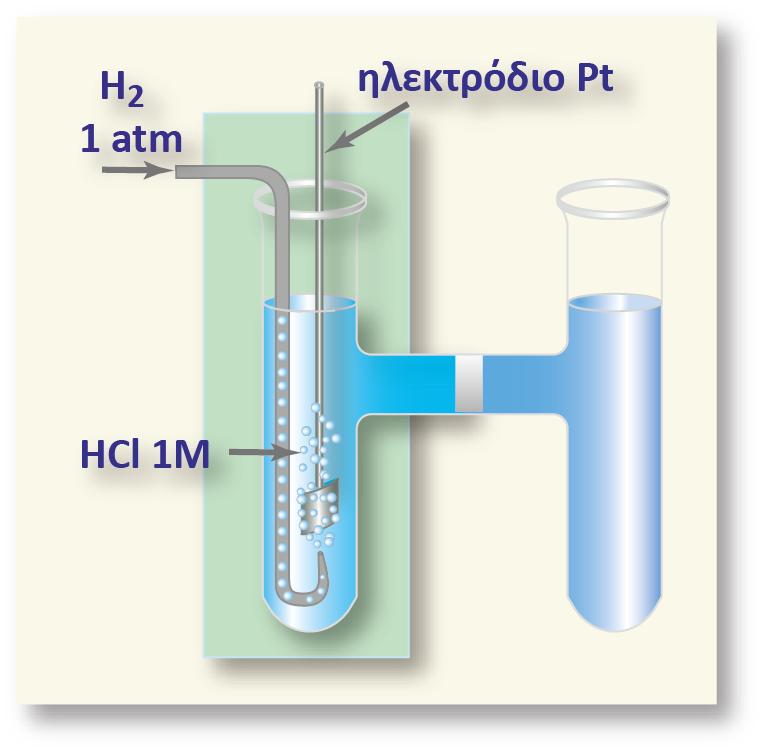
Μπορεί να μετρηθεί η διαφορά δυναμικού δύο ηλεκτροδίων. Έτσι το ηλεκτρόδιο του οποίου θέλουμε να μετρήσουμε το δυναμικό του, συνδυάζεται με ένα άλλο ηλεκτρόδιο διαφορετικού δυναμικού, βυθισμένο στο ίδιο διάλυμα, ή σε δύο διαφορετικά διαλύματα τα οποία βρίσκονται σε ηλεκτρική επαφή. Η ακριβής μέτρηση των δυναμικών κατέστη δυνατή με τη διάταξη του Johann Poggendorf (1796-1877) γνωστός για την ακριβή μέτρηση της διαφοράς δυναμικού.
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 2.6 ΣΧΕΣΗ ΔΥΝΑΜΙΚΟΥ ΕΝΕΡΓΟΤΗΤΑΣ e |
2.8 ΓΡΑΦΗ ΑΝΤΙΔΡΑΣΗΣ ΣΤΟ ΗΜΙΣΤΟΙΧΕΙΟ |
Προηγούμενο Επόμενο
2.6 ΣΧΕΣΗ ΔΥΝΑΜΙΚΟΥ ΕΝΕΡΓΟΤΗΤΑΣ e 2.8 ΓΡΑΦΗ ΑΝΤΙΔΡΑΣΗΣ ΣΤΟ ΗΜΙΣΤΟΙΧΕΙΟ