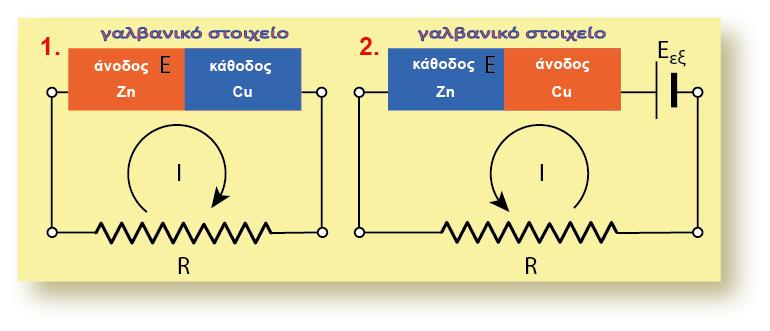
3.2 ΜΕΤΡΗΣΗ ΔΥΝΑΜΙΚΟΥ ΗΜΙΣΤΟΙΧΕΙΟΥ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 3.ΔΥΝΑΜΙΚA > 3.2 ΜΕΤΡΗΣΗ ΔΥΝΑΜΙΚΟΥ ΗΜΙΣΤΟΙΧΕΙΟΥ
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 3.1 ΜΕΤΡΗΣΗ ΔΥΝΑΜΙΚΟΥ ΒΟΛΤΟΜΕΤΡΟ |
3.3 ΠΡΟΤΥΠΟ ΗΛΕΚΤΡΟΔΙΟ ΥΔΡΟΓΟΝΟΥ |
Μέτρηση του δυναμικού ενός ημιστοιχείου
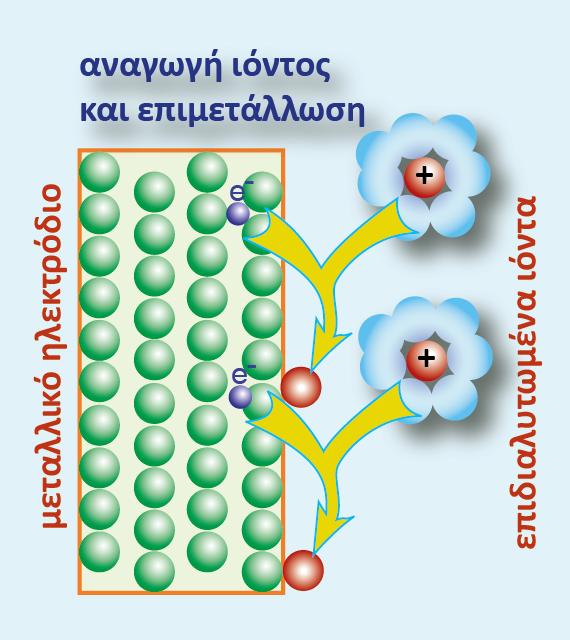
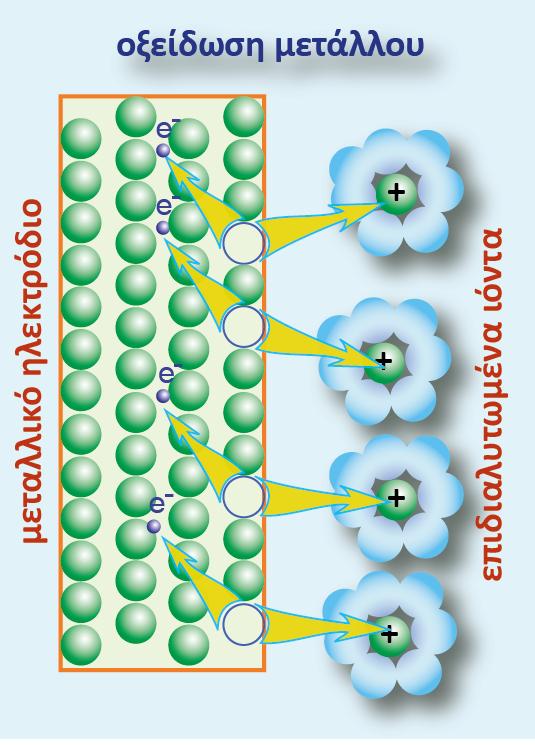
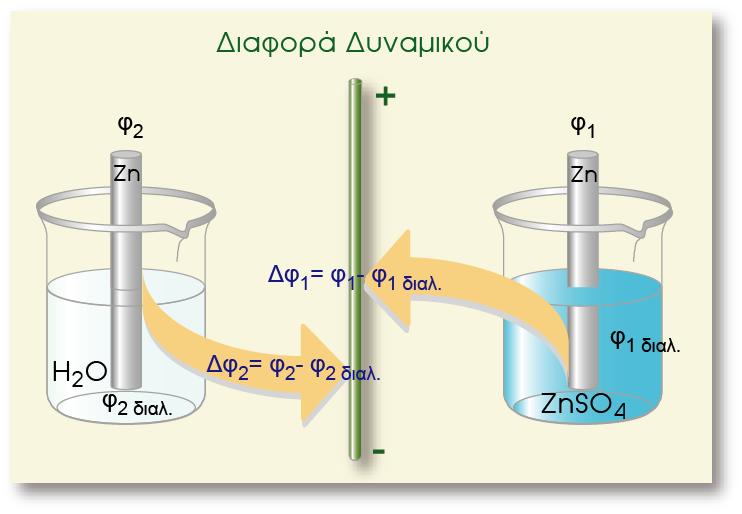
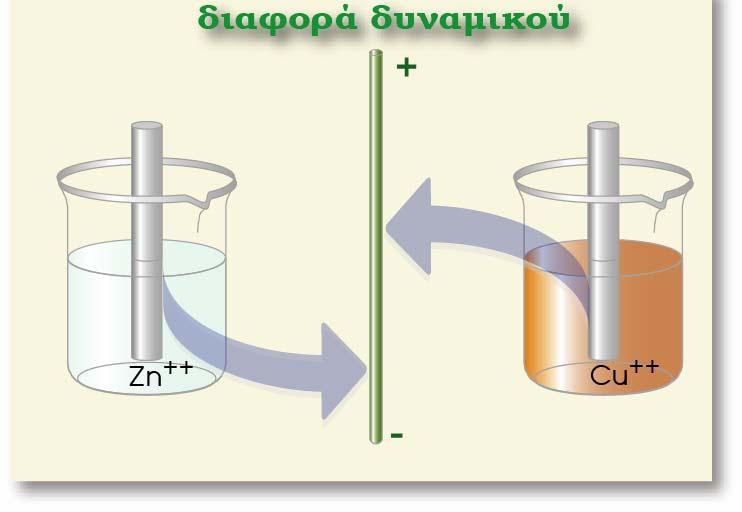
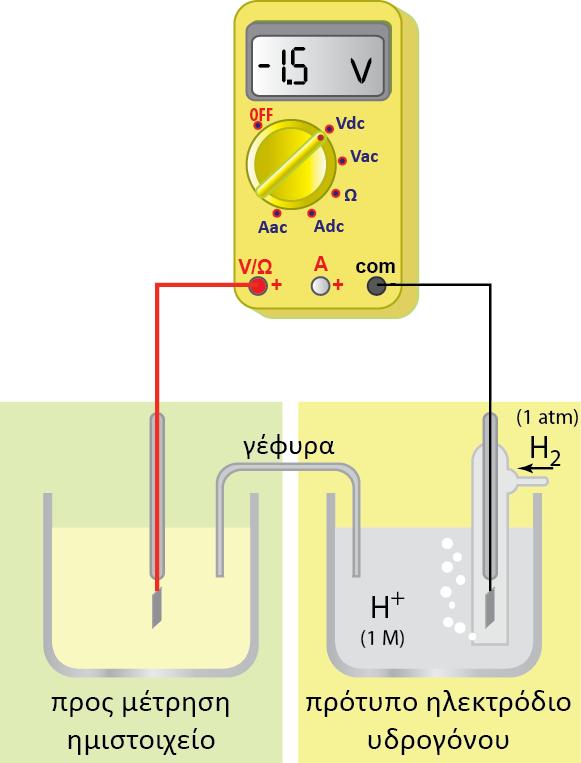
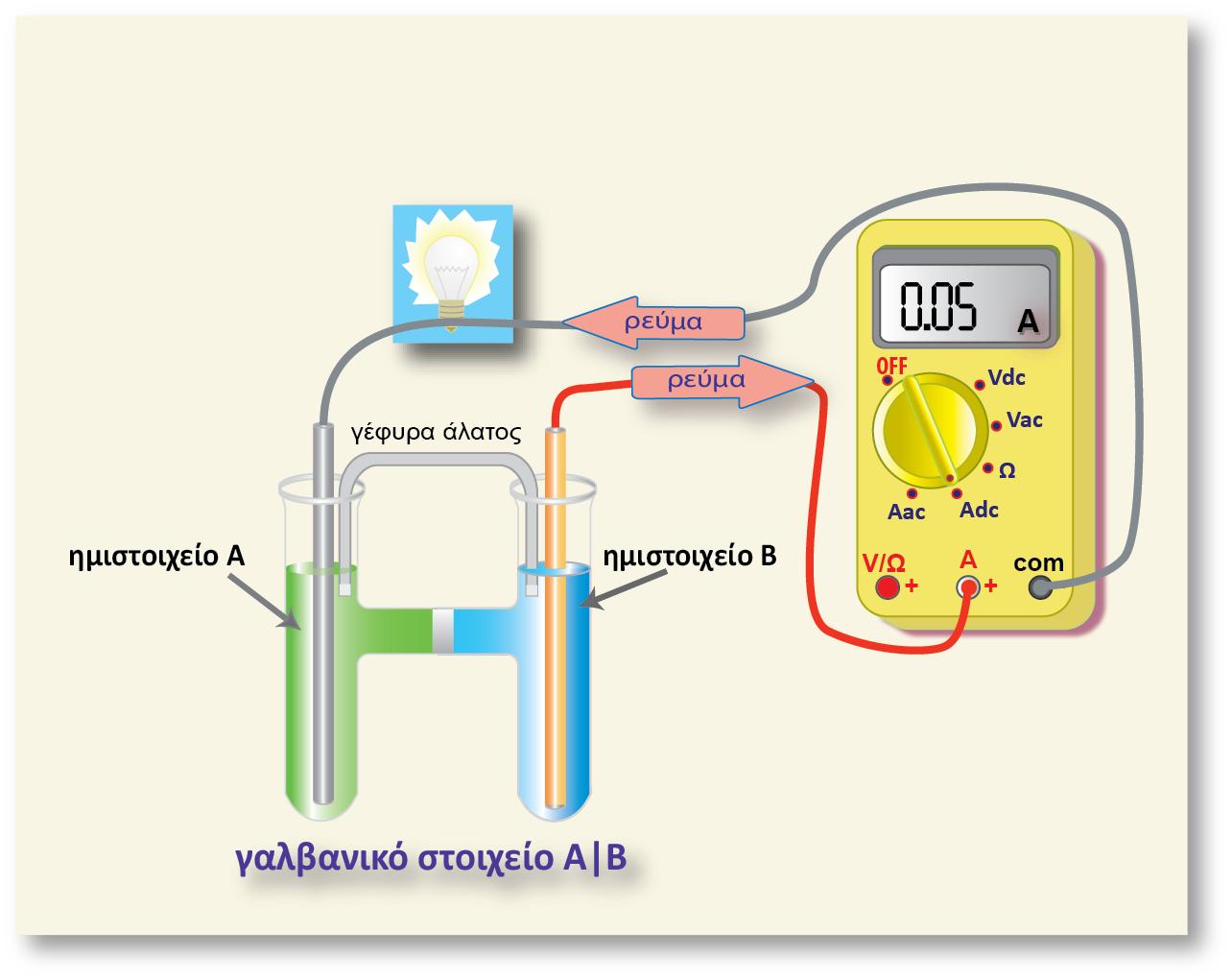
Σ? ένα οποιοδήποτε ημιστοιχείο [π.χ. Zn(s)|Zn2+(aq)] αναπτύσσεται διαφορά δυναμικού μεταξύ του ηλεκτροδίου (Zn) και του διαλύματος. Για να μετρήσουμε τη διαφορά δυναμικού, θα έπρεπε να τοποθετήσουμε το κόκκινο καλώδιο στην υποδοχή (+) του βολτομέτρου και να το συνδέσουμε με το έλασμα Zn (φZn), ενώ το μαύρο καλώδιο θα το τοποθετούσαμε στην υποδοχή (-) και την άλλη άκρη του θα την εμβαπτίζαμε μέσα στο διάλυμα (φακροδέκτη) όπως φαίνεται στο παρακάτω σχήμα.

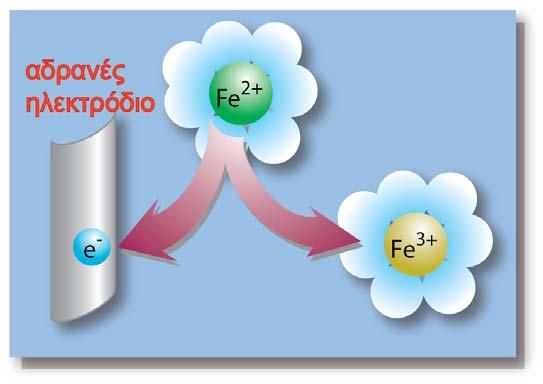
Εμβαπτιζόμενο όμως το μέταλλο του ακροδέκτη στο διάλυμα, εμφανίζει κι αυτό, ηλεκτροδιαλυτική τάση, με αποτέλεσμα να εμφανίζεται μια διαφορά δυναμικού μεταξύ του μετάλλου του ακροδέκτη και του διαλύματος. Έτσι η διαφορά δυναμικού που δείχνει το βολτόμετρο δεν είναι η διαφορά δυναμικού Ζη - διαλύματος, αλλά η διαφορά δυναμικού των δύο ηλεκτροδίων:
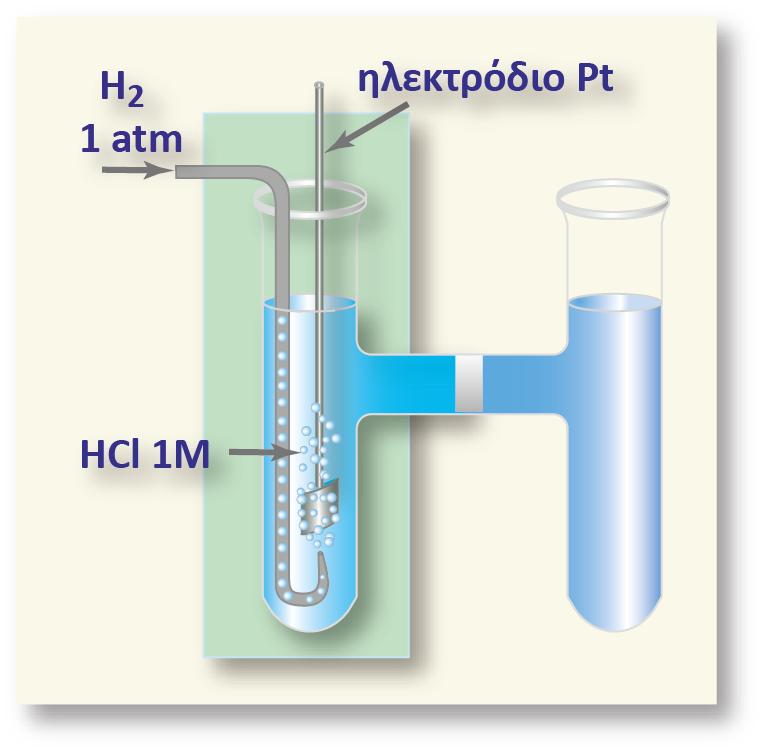
Με τον τρόπο αυτό, ανάλογα με τη φύση του μετάλλου του ακροδέκτη που χρησιμοποιούμε, παίρνουμε διαφορετική τιμή της διαφοράς δυναμικού και η μέτρηση δεν είναι επαναλήψιμη. Για να εμφανίζουν οι μετρήσεις επαναληψιμότητα, θα έπρεπε να χρησιμοποιείται από όλους το ίδιο μέταλλο στον ακροδέκτη. Αυτό όμως δημιουργεί πολλά προβλήματα. Οι επιστήμονες, για να παρακάμψουν το πρόβλημα αυτό, επέλεξαν ένα πρότυπο ηλεκτρόδιο και θεώρησαν το δυναμικό του κατά σύμβαση ίσο με μηδέν.
Αυτό το οποίο πρέπει να τονιστεί ιδιαίτερα, είναι ότι στην Ηλεκτροχημεία δεν είναι απαραίτητη η γνώση της τιμής του απόλυτου δυναμικού ενός ημιστοιχείου. Αυτό που μας ενδιαφέρει κυρίως, είναι η σύγκριση των δυναμικών δύο ημιστοιχείων. Αυτό είναι μία συνήθης πρακτική στη Χημεία. Για παράδειγμα σε μία χημική αντίδραση δεν μας ενδιαφέρει η απόλυτη ενέργεια
αντιδρώντων και προϊόντων, αλλά η διαφορά ενέργειας.
Έτσι και στα ημιστοιχεία, σύγκριση μπορεί επιτευχθεί έμμεσα συγκρίνοντας κάθε ημιστοιχείο ξεχωριστά με κάποιο τρίτο ημιστοιχείο, το οποίο όμως θα παρουσίαζε επαναληψιμότητα και θα είχε το ίδιο δυναμικό πάντα σε όποιο εργαστήριο του κόσμου και αν κατασκευαζόταν.
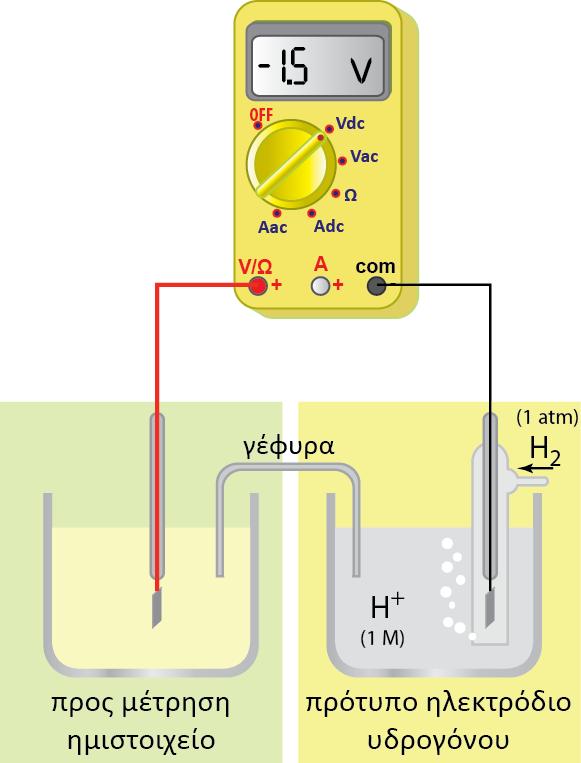
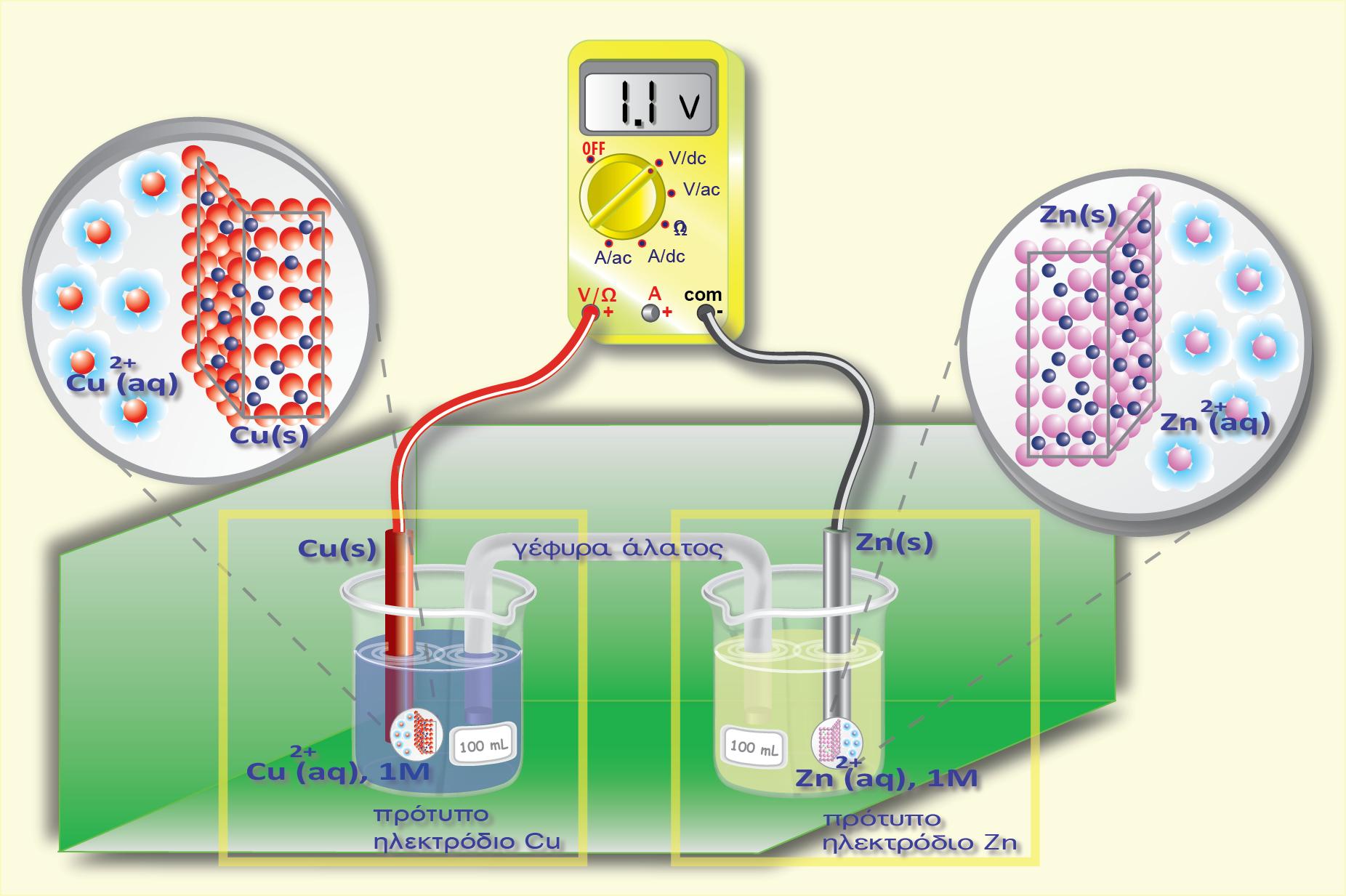
Θεωρούμε δύο ηλεκτρόδια-ημιστοιχεία και ως παράδειγμα παίρνουμε τα δύο ημιστοιχεία Ζn και Cu. Aν φέρουμε τα διαλύματά τους σε ηλεκτρολυτική επαφή με δύο απλές γέφυρες άλατος, τότε τα διαλύματα αποκτούν όλα το ίδιο δυναμικό (φsol). Σύμφωνα με τη συνδεσμολογία του παρακάτω σχήματος:

H διαφορά δυναμικού του ηλεκτροδίου του Zn ως προς το πρότυπο θα είναι:
και αντιστοιχεί στην ένδειξη του βολτομέτρου 1 (V1). Αντίστοιχα η ένδειξη του βολτομέτρου 2 (V2) θα είναι το δυναμικό του Cu ως προς το πρότυπο ηλεκτρόδιοκαι η ένδειξη του βολτομέτρου 3 (V3) θα είναι η διαφορά δυναμικού μεταξύ των δύο ηλεκτροδίων (Zn και Cu)
Παρατηρούμε ότι ανεξάρτητα από την όποια τιμή έχει το απόλυτο δυναμικό του πρότυπου ηλεκτροδίου, η διαφορά δυναμικού των δύο ηλεκτροδίων θα είναι η ίδια. Μπορούμε επομένως να θεωρήσουμε κατά σύμβαση μία τιμή 0 για το δυναμικό του πρότυπου ηλεκτροδίου, οπότε η διαφορά δυναμικού ενός ηλεκτροδίου ως προς το παγκοσμίως αποδεκτό πρότυπο ηλεκτρόδιο «αποδίδεται» πλέον ως τιμή του δυναμικού στο ηλεκτρόδιο και για να είναι εμφανές ότι αναφέρεται ως προς το πρότυπο ηλεκτρόδιο ονομάστηκε «πρότυπο δυναμικό» του ηλεκτροδίου.
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 3.1 ΜΕΤΡΗΣΗ ΔΥΝΑΜΙΚΟΥ ΒΟΛΤΟΜΕΤΡΟ |
3.3 ΠΡΟΤΥΠΟ ΗΛΕΚΤΡΟΔΙΟ ΥΔΡΟΓΟΝΟΥ |