3.3 ΠΡΟΤΥΠΟ ΗΛΕΚΤΡΟΔΙΟ ΥΔΡΟΓΟΝΟΥ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 3.ΔΥΝΑΜΙΚA > 3.3 ΠΡΟΤΥΠΟ ΗΛΕΚΤΡΟΔΙΟ Η2
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 3.2 ΜΕΤΡΗΣΗ ΔΥΝΑΜΙΚΟΥ ΗΜΙΣΤΟΙΧΕΙΟΥ | 3.4 ΠΡΟΤΥΠΟ ΔΥΝΑΜΙΚΟ ΚΑΙ ΜΕΤΡΗΣΗ ΤΟΥ |
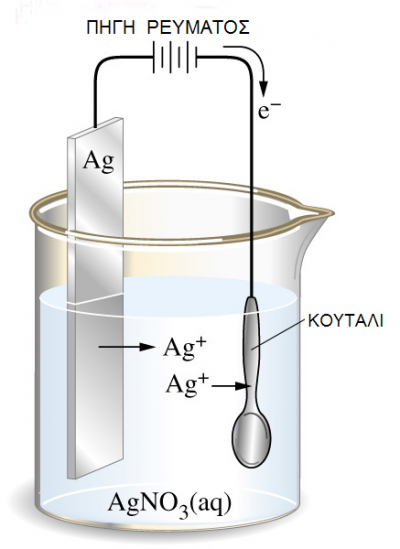
Κανονικό ή πρότυπο ηλεκτρόδιο υδρογόνου
Σύμφωνα με τη σύμβαση της I.U.P.A.C. (International Union of Pure and Applied Chemistry) ως πρότυπο ηλεκτρόδιο για τον καθορισμό των δυναμικών των ηλεκτροδίων και ημιστοιχείων επιλέχθηκε το πρότυπο ηλεκτρόδιο υδρογόνου το οποίο συμβολίζεται Π.Η.Υ. (Standard Hydrogen Electrode, SΗΕ).
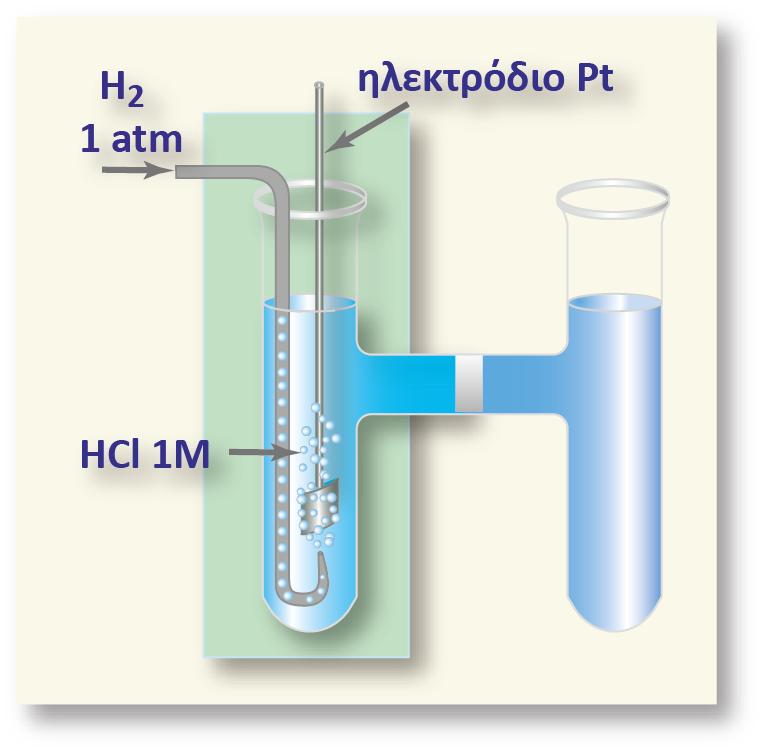
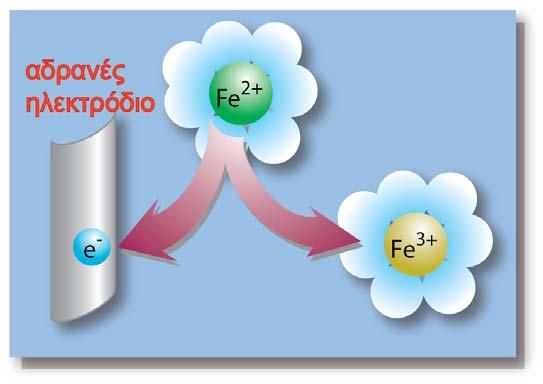
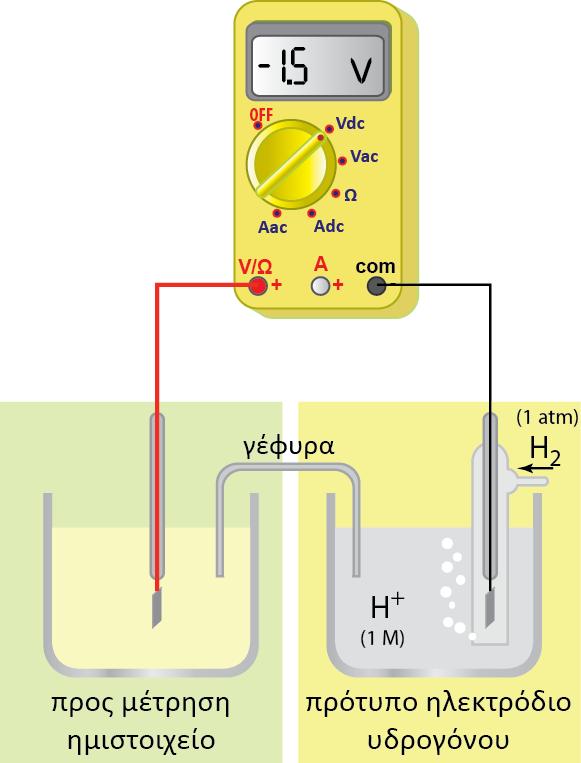
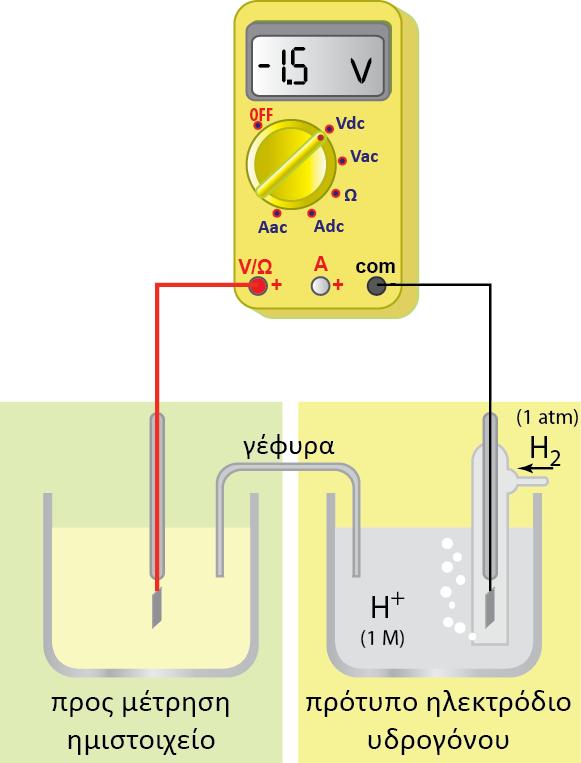
Για την κατασκευή του έχει επιλεγεί ως ηλεκτρόδιο αναφοράς (αδρανές), φύλλο καθαρού λευκοχρύσου. Το ηλεκτρόδιο του λευκοχρύσου (Pt) έχει τη μορφή ενός τετράγωνου φύλλου και έχει επικαλυφθεί (με ηλεκτρολυτική απόθεση) με λεπτά διαμερισμένο λευκόχρυσο (μαύρος λευκόχρυσος) ώστε να αυξηθεί η επιφάνειά του. Το ηλεκτρόδιο αυτό βρίσκεται μέσα σε διάλυμα υδροχλωρικού οξέος. Επάνω στην επιφάνεια του λευκοχρύσου διαβιβάζουμε συνεχώς αέριο υδρογόνο, με τη βοήθεια ενός γυάλινου σωλήνα (έκλουση υδρογόνου).
Ο λευκόχρυσος δρα καταλυτικά και διασπά τα μόρια του υδρογόνου σε ατομικό υδρογόνο σύμφωνα με την αντίδραση:
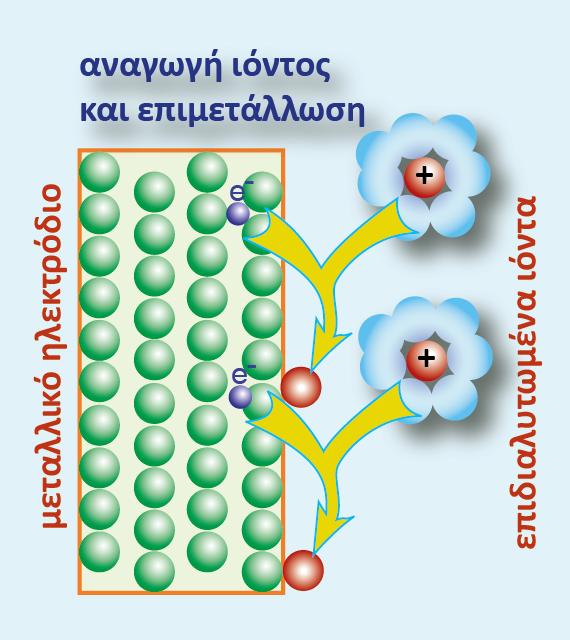
Τα άτομα του υδρογόνου προσροφώνται (adsorption ? εξ ου και το ad, συντομογραφία της λέξης στο συμβολισμό Η(ad)) στην επιφάνεια του λευκοχρύσου και συμπεριφέρονται όπως και τα άτομα στην εξωτερική επιφάνεια ενός μεταλλικού ηλεκτροδίου, δηλαδή εμφανίζεται κι εδώ ηλεκτροδιαλυτική τάση σύμφωνα με την αντίδραση:
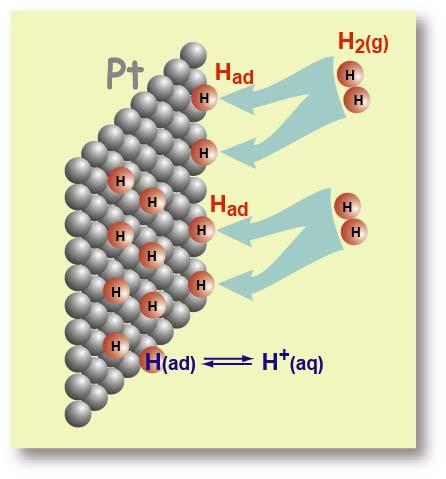
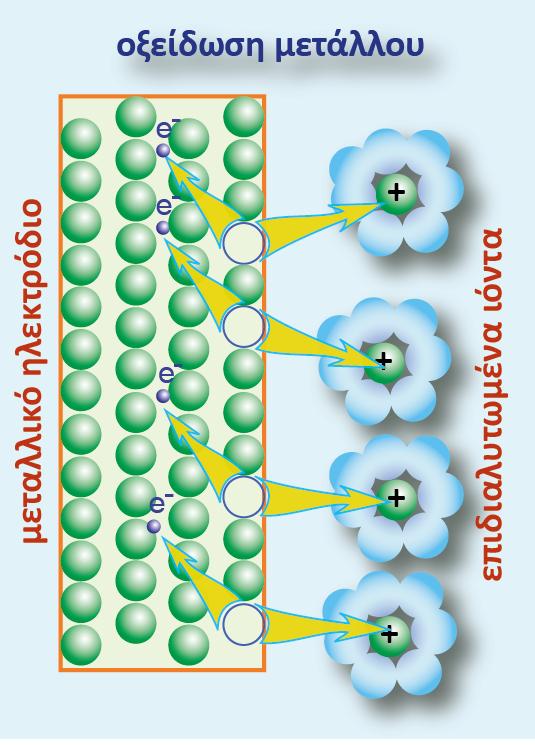
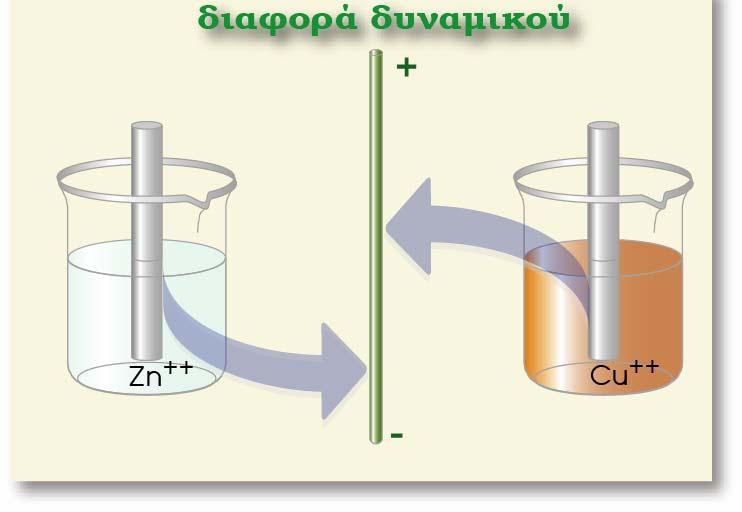
Δηλαδή υδρογονοκατιόντα μεταβαίνουν στο διάλυμα του υδροχλωρικού οξέος, εγκαταλείποντας ηλεκτρόνια στο μέταλλο και εμφανίζεται διαφορά δυναμικού (ως προς το διάλυμα) στο ηλεκτρόδιο του λευκοχρύσου. Εν τέλει αποκαθίσταται ισορροπία μεταξύ του προσροφημένου υδρογόνου και των υδρογονοκατιόντων που υπάρχουν στο διάλυμα.
Αν γράψουμε την ολική αντίδραση γίνεται εμφανές ότι για να καθορίσουμε εμείς το δυναμικό του ηλεκτροδίου (δηλαδή τη συγκέντρωση των ηλεκτρονίων), πρέπει να καθορίσουμε τη θέση ισορροπίας της αντίδρασης. Η θέση ισορροπίας επηρεάζεται όπως βλέπουμε στην αντίδραση από:
i) την πίεση του αερίου
ii) τη συγκέντρωση των υδρογονοκατιόντων (H+)
iii) τη θερμοκρασία
Για να υπάρχουν επομένως επαναλήψιμα και συγκρίσιμα αποτελέσματα, αποφασίστηκε η πίεση του αερίου υδρογόνου να είναι ίση με 1atm (ή πιο σωστά 1 bar) και το διάλυμα του υδροχλωρικού οξέος να έχει συγκέντρωση1Μ (ή πιο σωστά ενεργότητα, α, ίση με τη μονάδα). Ρυθμίζοντας με τον τρόπο αυτό όλες τις παραμέτρους που επηρεάζουν τη θέση της ισορροπίας, έχουμε καθορίσει και τη συγκέντρωση των ηλεκτρονίων και, συνεπώς, και το δυναμικό του ηλεκτροδίου του λευκοχρύσου.
Το ημιστοιχείο αυτό αναφοράς, θεωρήθηκε ότι στους 25 οC έχει δυναμικό ίσο με μηδέν και ονομάστηκε πρότυπο ηλεκτρόδιο υδρογόνου. Προτιμήθηκε ως ηλεκτρόδιο αναφοράς, γιατί το δυναμικό οξειδοαναγωγής του βρίσκεται περίπου στη μέση των δυναμικών όλων των άλλων ηλεκτροδίων. Το πρότυπο ηλεκτρόδιο υδρογόνου σχεδιάζεται για P = 1 atm,
[H+] =1M(π.χ.CHCl= 1M) και θ = 25 0C και συμβολίζεται:
Συνδυάζοντας αυτό το ηλεκτρόδιο αναφοράς με ημιστοιχεία άλλων μετάλλων, είναι δυνατόν να μετρηθεί πειραματικά, η διαφορά δυναμικού μεταξύ του πρότυπου ηλεκτροδίου του υδρογόνου, φΗ και του άλλου μετάλλου, φΜ. Η μετρούμενη αυτή διαφορά δυναμικού είναι ίση με το δυναμικό του μετάλλου (ή του ημιστοιχείου), αφού το δυναμικό του ηλεκτροδίου του υδρογόνου θεωρείται ίσο με μηδέν:
|
|||||
| |