2.3 ΚΑΤΗΓΟΡΙΕΣ ΗΜΙΣΤΟΙΧΕΙΩΝ
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 2. ΗΜΙΣΤΟΙΧΕΙΑ > 2.3 ΚΑΤΗΓΟΡΙΕΣ ΗΜΙΣΤΟΙΧΕΙΩΝ
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 2.2 Ο ΡΟΛΟΣ ΤΟΥ ΗΛΕΚΤΡΟΔΙΟΥ |
2.4 ΔΥΝΑΜΙΚΟ ΗΜΙΣΤΟΙΧΕΙΟΥ |
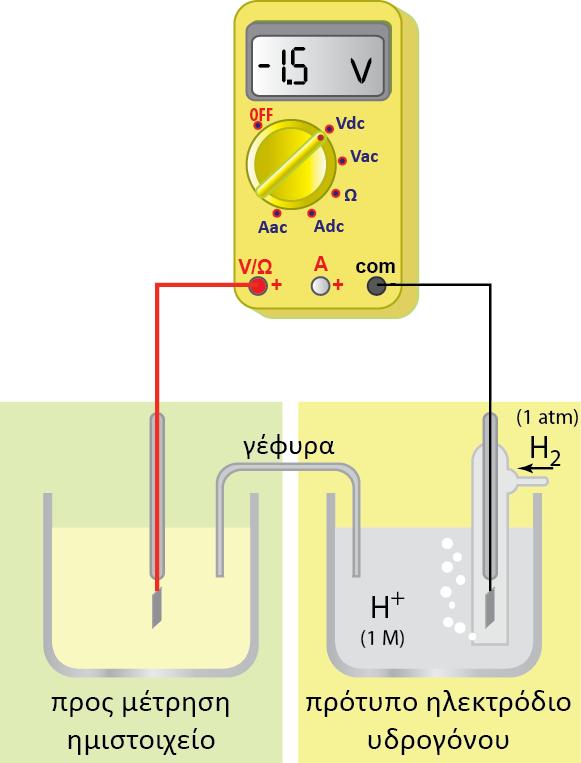
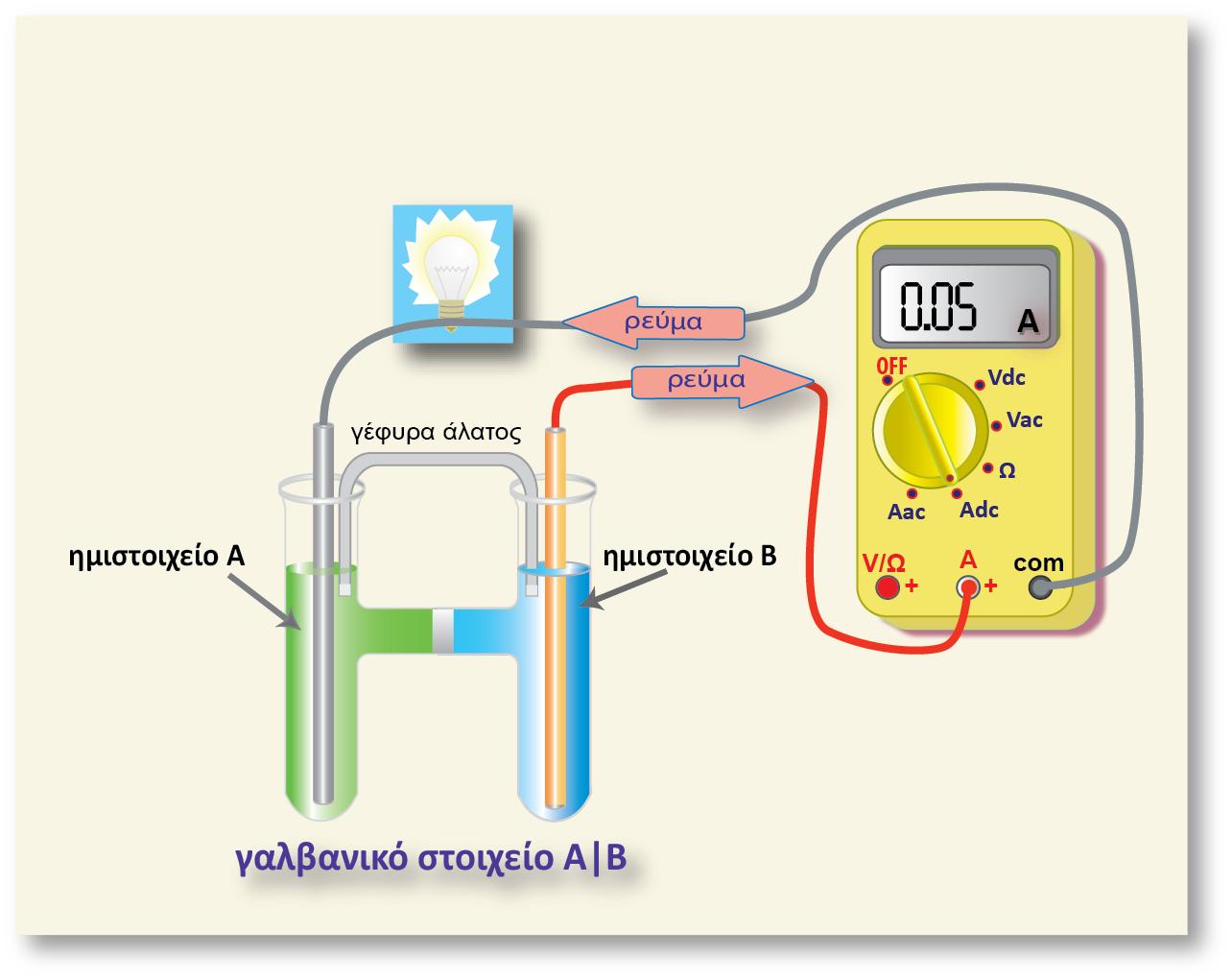
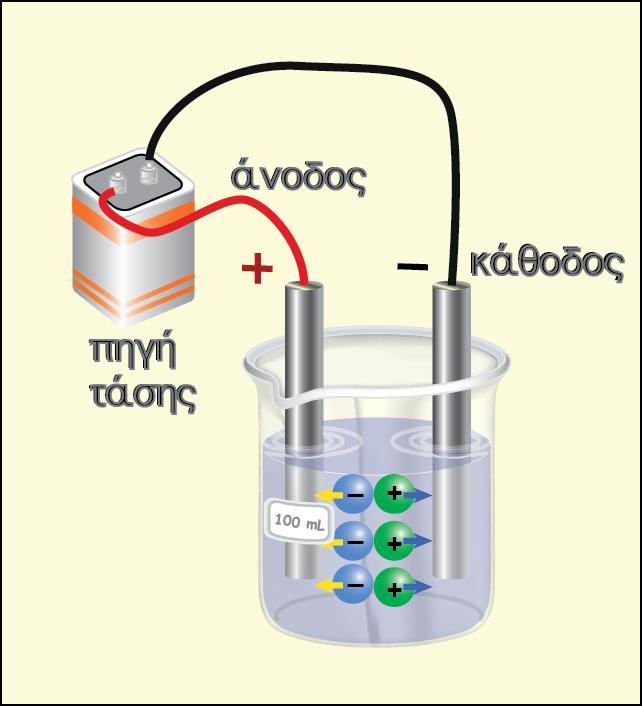
Κατηγορίες ημιστοιχείων
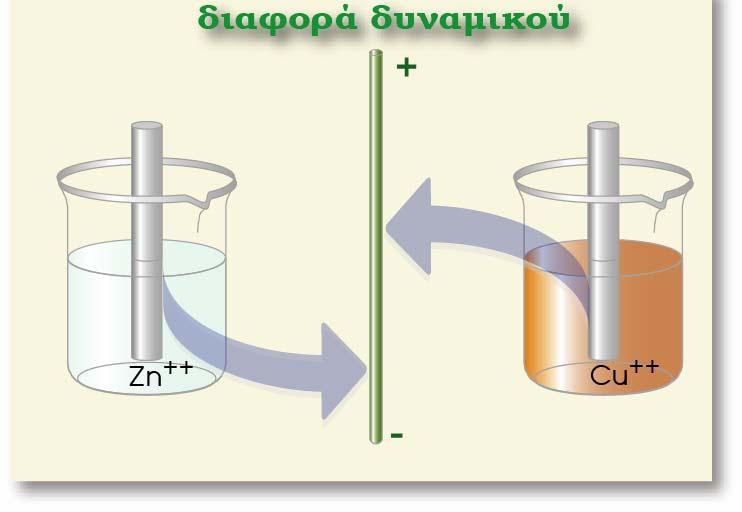
Ένα ημιστοιχείο αποτελείται πάντα από δύο μορφές της ίδιας χημικής οντότητας (ατομικής, μοριακής ή ιοντικής) που βρίσκονται σε διαφορετικές καταστάσεις οξείδωσης. Αυτές οι δύο μορφές (αναγμένη και οξειδωμένη μορφή) αποτελούν το οξειδοαναγωγικό ζεύγος του ημιστοιχείου.
Οι κυριότερες κατηγορίες ημιστοιχείων, είναι:
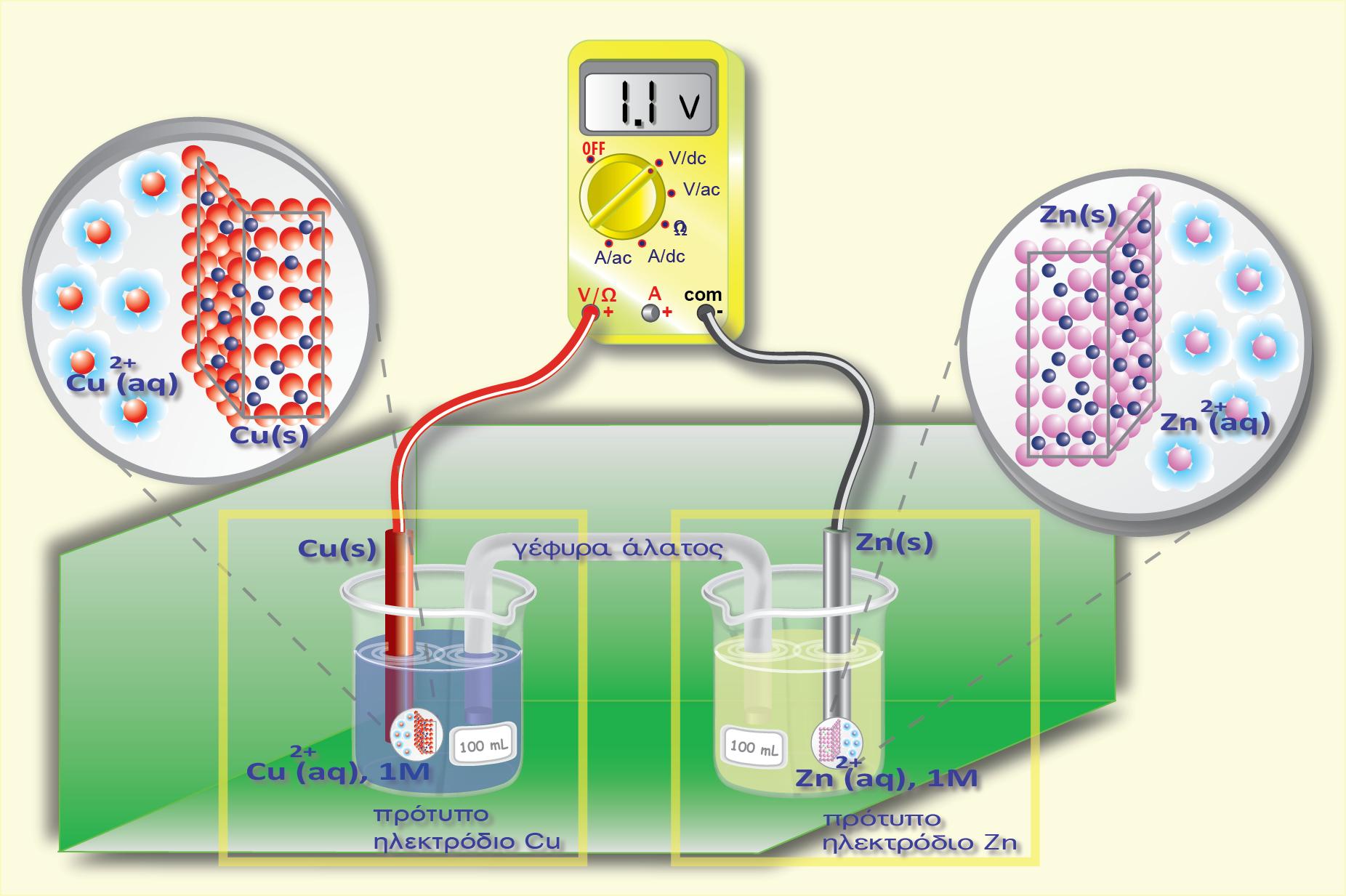
1. Μεταλλοκατιονικό ηλεκτρόδιο ή απλά κατιονικό ηλεκτρόδιο.
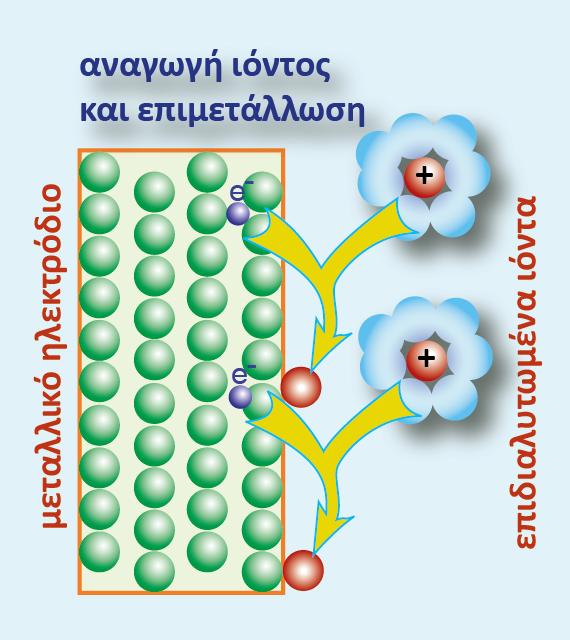
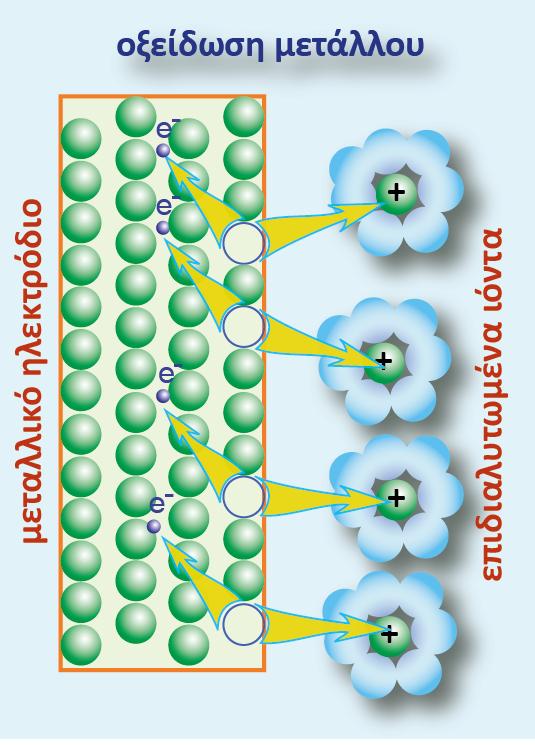
Προκύπτει αν βυθίσουμε τη ράβδο ενός μετάλλου Μ (που δεν αντιδρά με το νερό) μέσα σε νερό ή σε διάλυμα που περιέχει ιόντα του (Μn+). Η αναγμένη μορφή (Red) είναι το ίδιο το μεταλλικό ηλεκτρόδιο, το οποίο στην πραγματικότητα εκτελεί ταυτόχρονα δύο λειτουργίες:
? οξειδώνεται και αποβάλλονται ηλεκτρόνια σύμφωνα με την παρακάτω αντίδραση:
![]()
? χρησιμεύει σαν αγωγός-φορέας των ηλεκτρονίων που προέκυψαν από την οξείδωση.
Την οξειδωμένη μορφή (Ox) αποτελούν τα κατιόντα του μετάλλου (Μn+), τα οποία ανάγονται σύμφωνα με την αντίδραση:
![]()
Γενικά μπορούμε να πούμε ότι: ο συνδυασμός ενός μετάλλου Μ και του ηλεκτρολυτικού διαλύματός του, που περιέχει τα κατιόντα του μετάλλου, ονομάζεται μεταλλοκατιονικό ηλεκτρόδιο ή κατιονικό ηλεκτρόδιο και συμβολίζεται:
![]()
όπου C η συγκέντρωση των κατιόντων.
2. Ηλεκτρόδια ή ημιστοιχεία οξειδοαναγωγής.
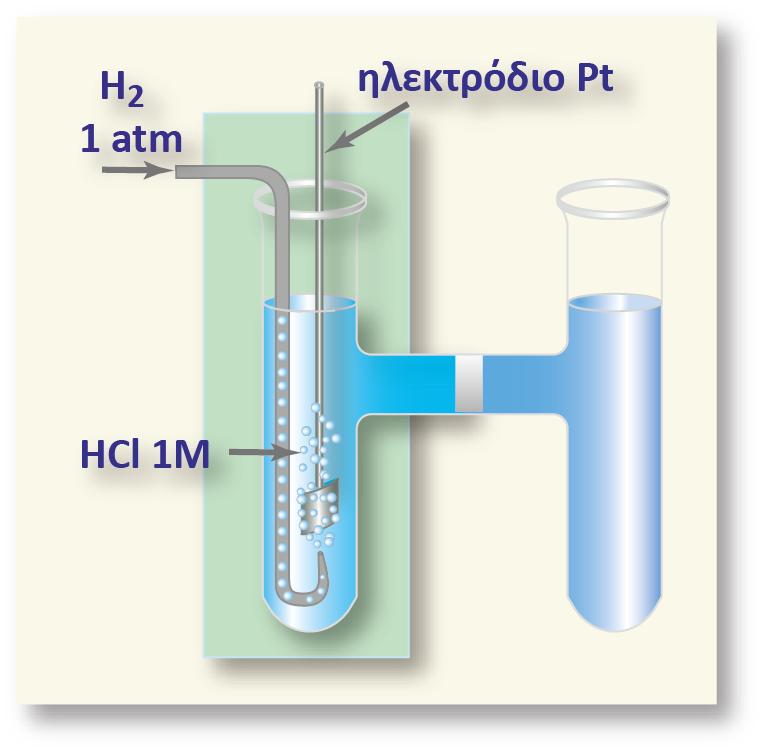
Έστω ότι χρησιμοποιούμε ένα ηλεκτρόδιο από αδρανές υλικό, δηλαδή από ένα υλικό το οποίο δεν παρουσιάζει ηλεκτροδιαλυτική τάση και έτσι η εμβάπτισή του στο ηλεκτρολυτικό διάλυμα δε θα έχει ως αποτέλεσμα την εμφάνιση διαφοράς δυναμικού μεταξύ του ηλεκτροδίου και του διαλύματος που θα οφείλεται σε κάποια οξειδοαναγωγική αντίδραση στην οποία συμμετέχει το υλικό αυτό. Τέτοια ηλεκτρόδια αποτελούνται από λευκόχρυσο, χρυσό ή από κάποια αγώγιμη μορφή του άνθρακα (π.χ. γραφίτης ή υαλώδης άνθρακας).
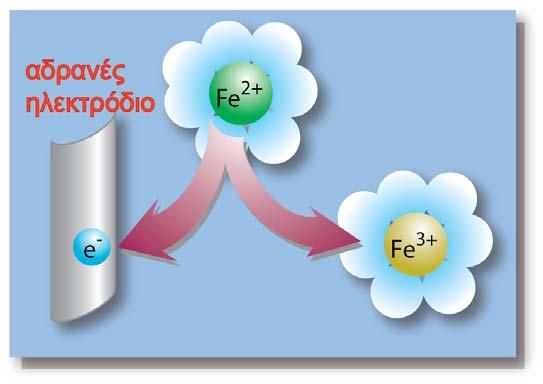
Βυθίζουμε το αδρανές ηλεκτρόδιο μέσα σε διάλυμα FeCl3. Μέσα στο διάλυμα υπάρχουν κατιόντα Fe3+. Γνωρίζουμε ότι ο σίδηρος μπορεί να υπάρχει σε ένα διάλυμα με τη μορφή και άλλης βαθμίδας (κατάστασης) οξείδωσης, το δισθενή σίδηρο Fe2+. Ο Fe3+ μπορεί να μετατραπεί σε Fe2+ προσλαμβάνοντας ένα ηλεκτρόνιο σύμφωνα με την αντίδραση:
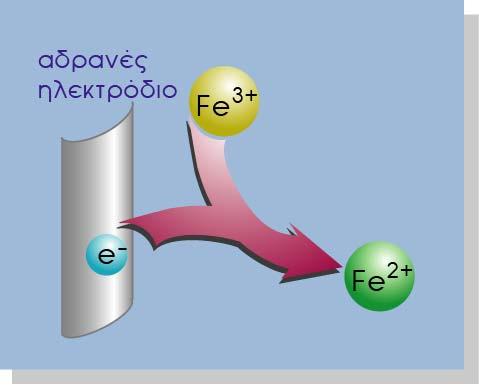
Ημιστοιχείο οξειδοαναγωγής
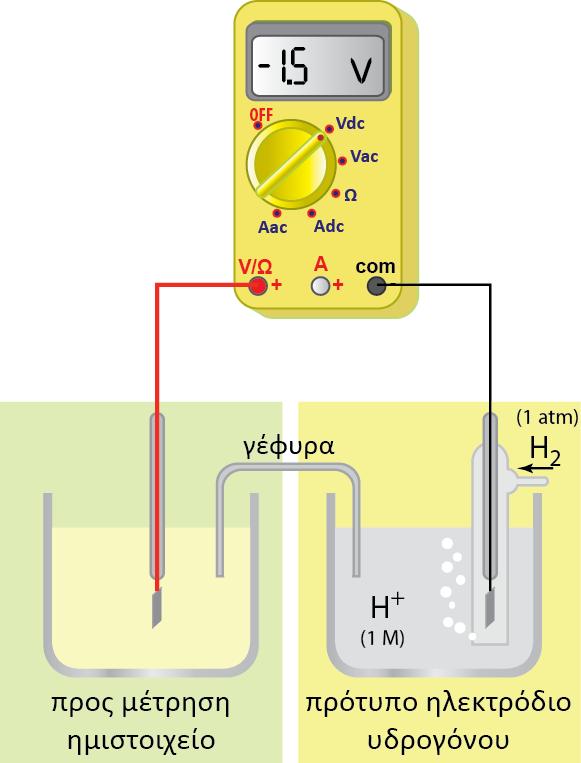
Στην αρχή μέσα στο διάλυμα, υπήρχε ηλεκτροουδετερότητα (τα θετικά φορτία από τα ιόντα Fe3+ ήταν ίσα με τα αρνητικά ιόντα Cl-). Τώρα με την μετατροπή των κατιόντων Fe3+ σε Fe2+ πλεονάζουν τα αρνητικά φορτία. Αυτό έχει ως αποτέλεσμα το διάλυμα να αποκτά αρνητικό δυναμικό. Ωστόσο μετά από κάποιο χρονικό διάστημα εξαιτίας των ηλεκτροστατικών δυνάμεων σταματά η παραπέρα πρόσληψη ηλεκτρονίων από το ηλεκτρόδιο (το αδρανές ηλεκτρόδιο χρησιμεύει μόνο σαν αγωγός-δεξαμενή των ηλεκτρονίων) και δημιουργείται και σταθεροποιείται μία διαφορά δυναμικού μεταξύ του διαλύματος και του ηλεκτροδίου. Το παραπάνω σύστημα ονομάζεται ηλεκτρόδιο ή ημιστοιχείο οξειδοαναγωγής.
Για να συμβολίσουμε το ηλεκτρόδιο οξειδοαναγωγής συνήθως πρώτα γράφουμε την αναγμένη μορφή και μετά την οξειδωμένη, χωρίζοντας τες με ένα κόμμα, επειδή βρίσκονται και οι δύο μορφές μέσα στο ηλεκτρολυτικό διάλυμα.
Έτσι για το παραπάνω ημιστοιχείο χρησιμοποιούμε το συμβολισμό:
Pt|Fe2+(aq,C1), Fe3+(aq, C2).
Άλλα ημιστοιχεία οξειδοαναγωγής που μπορούν να δημιουργηθούν είναι των παρακάτω οξειδοαναγωγικών ζευγών:
Sn2+(aq),Sn4+(aq),Cr2+(aq),Cr3+(aq),Co2+(aq),Co3+(aq).
Όπως στα κατιονικά ημιστοιχεία έτσι και στην περίπτωση αυτη, η διαφορά δυναμικού εξαρτάται από την ποσότητα των ηλεκτρονίων. Η ποσότητα των ηλεκτρονίων με τη σειρά της εξαρτάται από τη θέση ισορροπίας της ημιαντίδρασης:
και αυτή (θέση ισορροπίας) από τη συγκέντρωση των Fe3+ που είχαμε αρχικά στο διάλυμα.
Θα μπορούσαμε φυσικά στο διάλυμα να είχαμε προσθέσει από την αρχή Fe3+ (ως FeCl3) και Fe2+ (διαλύοντας π.χ. κάποια ποσότητα FeCl2) οπότε το δυναμικό του ηλεκτροδίου θα εξαρτιόταν και από τη συγκέντρωση του Fe3+ και από τη συγκέντρωση του Fe2+. Το κανονικό δυναμικό ενός τέτοιου ηλεκτροδίου οξειδοαναγωγής είναι ανεξάρτητο από το υλικό του αδρανού ηλεκτροδίου.
3. Ανιονικά ηλεκτρόδια ή ημιστοιχεία.
Στην κατηγορία αυτή υπάγονται κυρίως τα ηλεκτρόδια αερίων στα οποία η οξειδωμένη μορφή είναι κάποιο αέριο και η αναγμένη μορφή τα ανιόντα του που βρίσκονται στο διάλυμα.
Στην κατηγορία των ανιονικών ηλεκτροδίων υπάγονται τα ηλεκτρόδια των αλογόνων και το πολύ σημαντικό ηλεκτρόδιο του οξυγόνου.
Ορισμένα ανιονικά ηλεκτρόδια είναι: (Pt| Ι-, Ι2) , (Pt| Br-, Br2) , (Pt| O2, H+) , (Pt| F-, F2).
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 2.2 Ο ΡΟΛΟΣ ΤΟΥ ΗΛΕΚΤΡΟΔΙΟΥ |
2.4 ΔΥΝΑΜΙΚΟ ΗΜΙΣΤΟΙΧΕΙΟΥ |