4.1 ΕΞΙΣΩΣΗ Nernst
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 4. Nernst > 4.1 ΕΞΙΣΩΣΗ Nernst
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 4. ΚΕΦΑΛΑΙΟ |
4.2 ΕΦΑΡΜΟΓΕΣ ΕΞΙΣΩΣΗΣ Nernst |
Εξίσωση Nernst
Μια αντίδραση πραγματοποιείται αυθόρμητα όταν η ελεύθερη ενέργειά της μειώνεται, δηλαδή ΔG<0. Αν οι συνθήκες είναι πρότυπες, τότε η ελεύθερη ενέργεια συμβολίζεται ΔG0. Η σχέση που συνδέει την ελεύθερη ενέργεια (ΔG) με την πρότυπη ελεύθερη ενέργεια (ΔG0) , δίνεται παρακάτω:
? R είναι η παγκόσμια σταθερά των αερίων ίση με 8,314 J/(mol.K)
? T η απόλυτη θερμοκρασία σε Kelvin (K)
? Q ο λόγος του γινομένου των συγκεντρώσεων (ή των μερικών πιέσεων) των προϊόντων προς το γινόμενο των συγκεντρώσεων (ή των μερικών πιέσεων) των αντιδρώντων υψωμένων σε δύναμη με εκθέτη το συντελεστή τους που υπάρχει στη χημική εξίσωση:
Από τη σχέση (1) με αντικατάσταση του Q προκύπτει η παρακάτω σχέση:
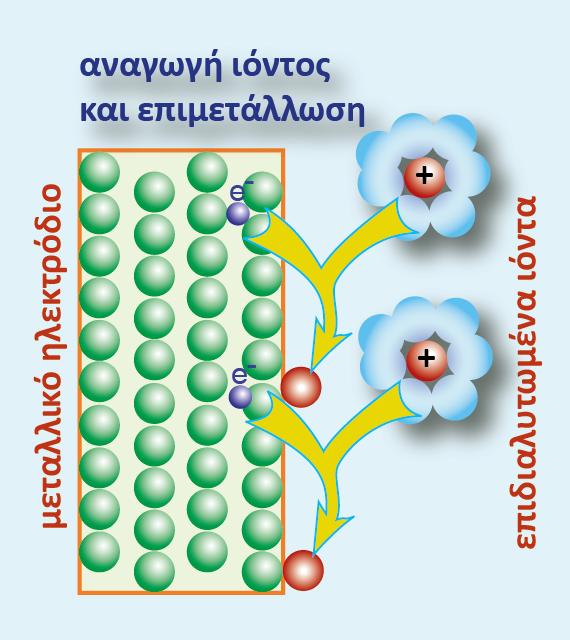
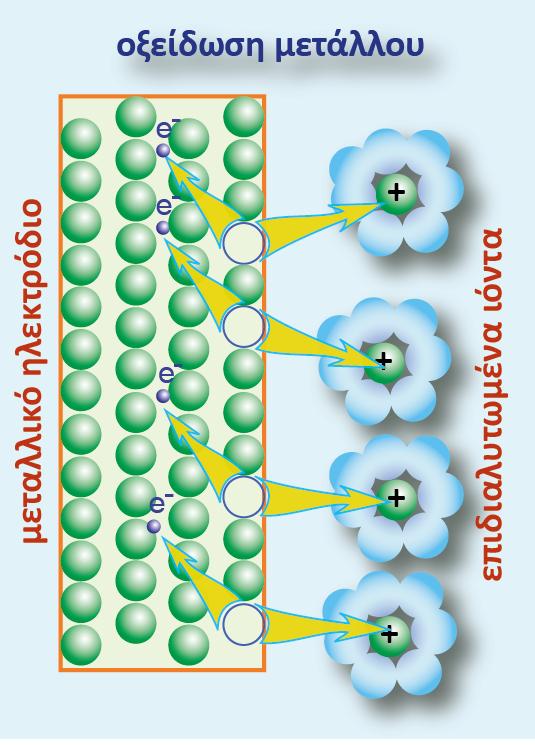
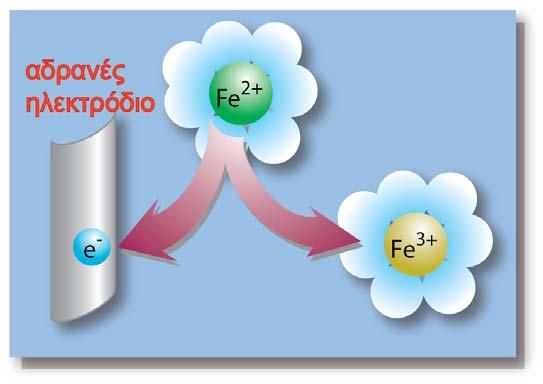
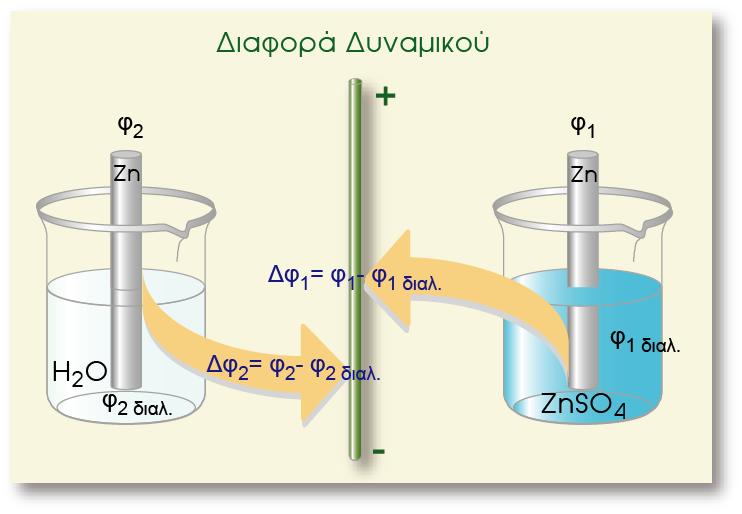
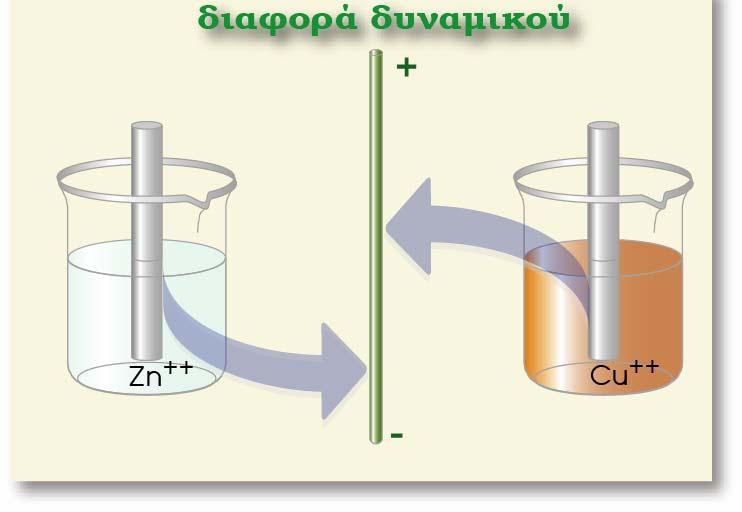
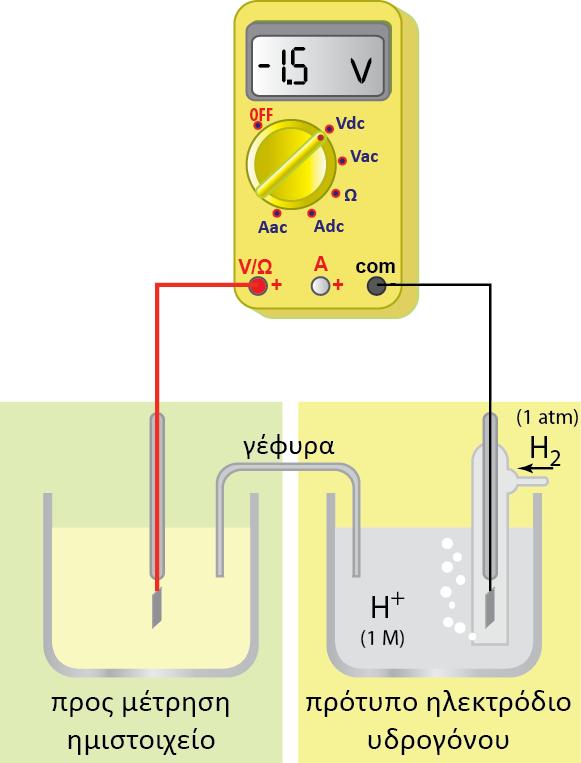
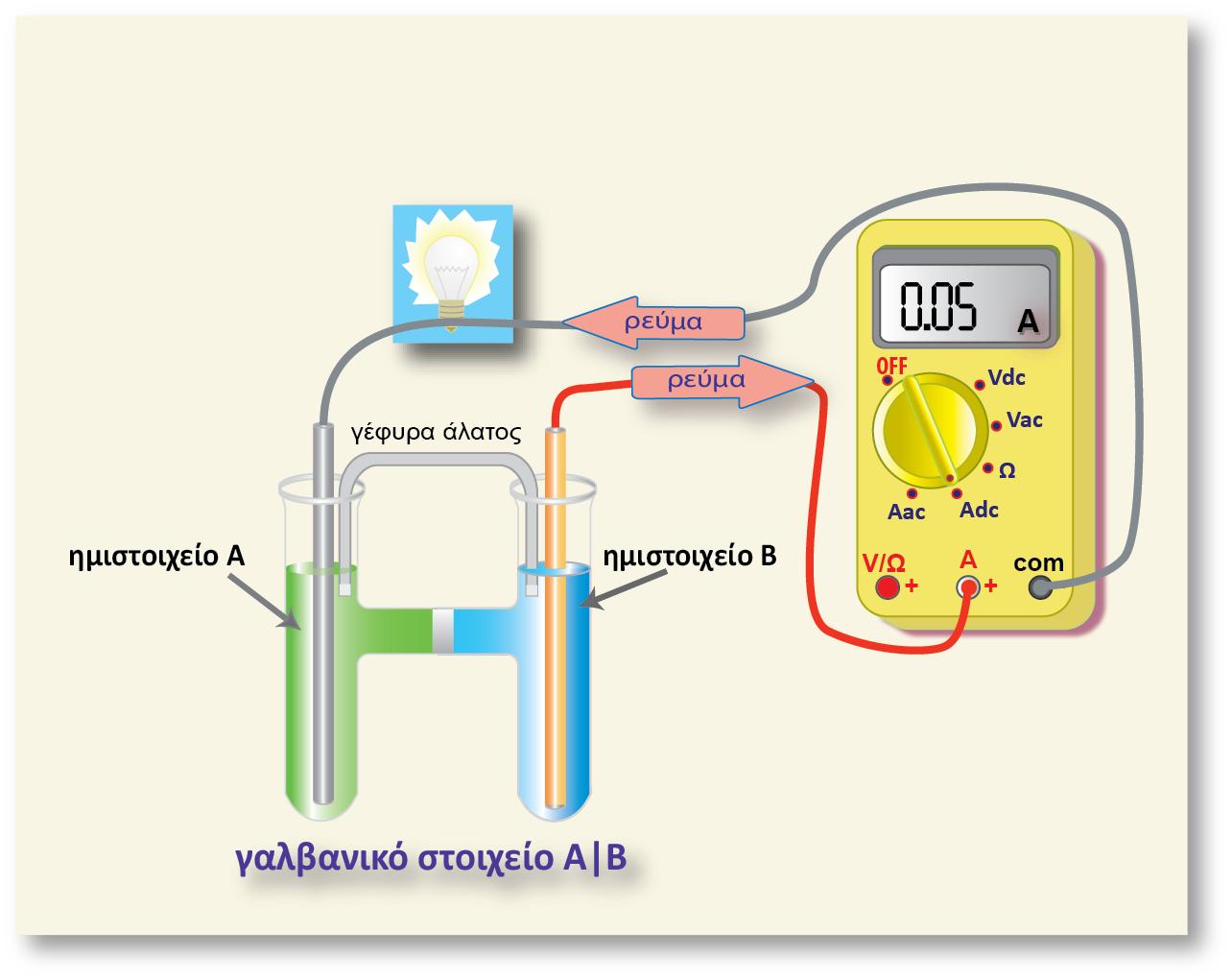
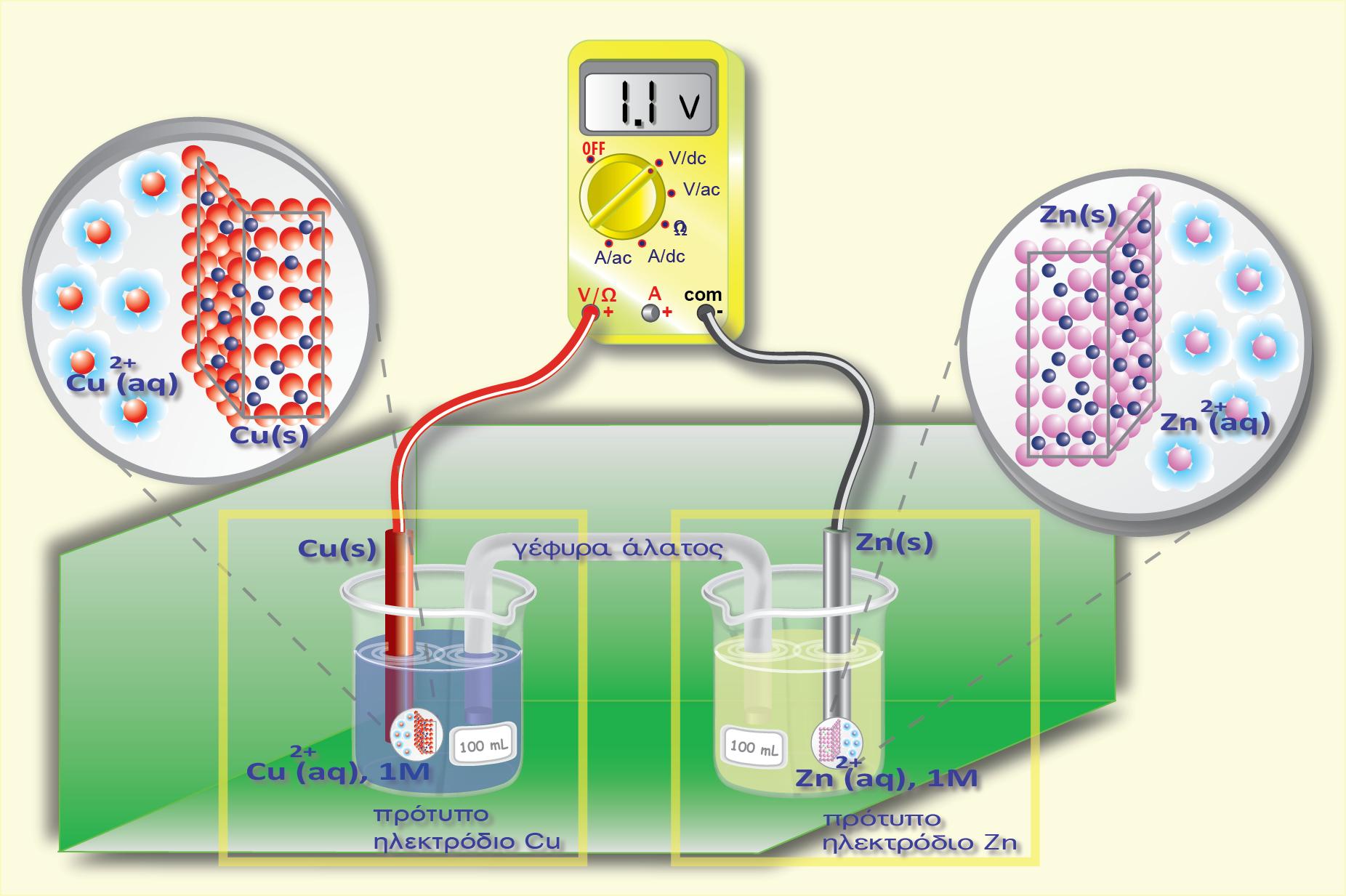
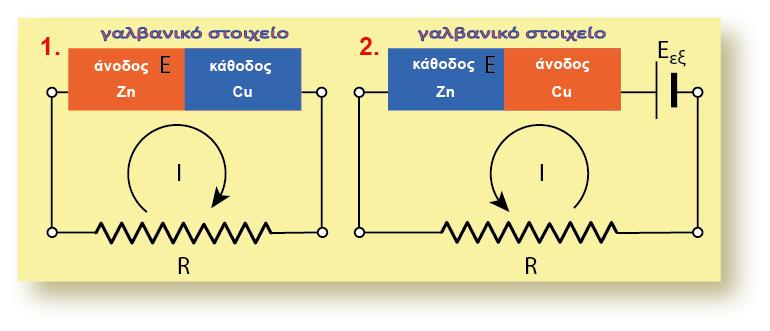
Σε μία οξειδοαναγωγική αντίδραση, μεταφέρονται ηλεκτρόνια (ηλεκτρικό φορτίο) από μία ένωση σε μία άλλη. Σε ένα γαλβανικό στοιχείο η μία ένωση βρίσκεται στο ένα ημιστοιχείο και η άλλη στο άλλο ημιστοιχείο. Το ηλεκτρικό φορτίο κινείται από το δυναμικό του ενός ημιστοιχείου στο δυναμικό του άλλου ημιστοιχείου. Έχουμε επομένως κίνηση ηλεκτρικού φορτίου q σε διαφορά δυναμικού V (το δυναμικό του στοιχείου). Η σχέση που δίνει την ενέργεια της κίνησης του φορτίου είναι η γνωστή από την Φυσική:
Ανά mol όμως αντιδρώσας ουσίας ισχύει q= -n.F
Έτσι η ελεύθερη ενέργεια συνδέεται με το δυναμικό του στοιχείου με την παρακάτω σχέση:
Αν οι συνθήκες είναι πρότυπες, τότε ισχύει η σχέση:
Με αντικατάσταση των σχέσεων (4) και (5) στη σχέση (1) προκύπτει:
Αν διαιρέσουμε και τα δύο μέλη της παραπάνω εξίσωσης με τον όρο (?n.F), τότε προκύπτει η σχέση:
Η σχέση (7) ονομάζεται εξίσωση Nernst. Ονομάστηκε έτσι από το Γερμανό χημικό Walther Nernst ο οποίος την παρήγαγε. Αν αντικαταστήσουμε το ln με το log τότε προκύπτει:
Εάν η θερμοκρασία είναι 250 C, τότε ο όρος 2,303RT/F παίρνει την τιμή 0,059 (σε V) και από την παραπάνω σχέση προκύπτει:
Με εφαρμογή της εξίσωσης Nernst στην οξειδοαναγωγική αντίδραση προκύπτει η παρακάτω σχέση:
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 4. ΚΕΦΑΛΑΙΟ |
4.2 ΕΦΑΡΜΟΓΕΣ ΕΞΙΣΩΣΗΣ Nernst |