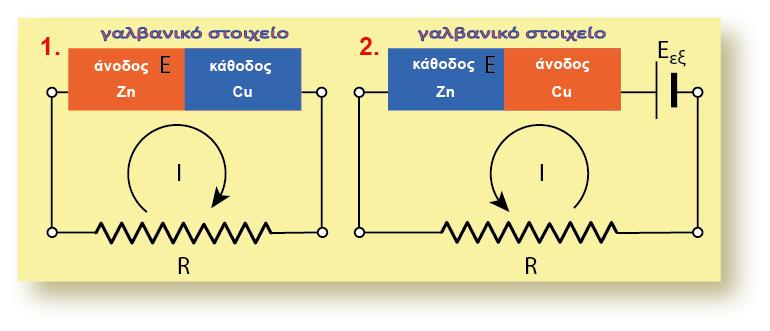
4.2 ΕΦΑΡΜΟΓΕΣ ΕΞΙΣΩΣΗΣ Nernst
ΒΡΙΣΚΕΣΤΕ ΕΔΩ: ΑΡΧΗ > 4. Nernst > 4.2 ΕΦΑΡΜΟΓΕΣ ΕΞΙΣΩΣΗΣ Nernst
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 4.1 ΕΞΙΣΩΣΗ Nernst | 5 ΚΕΦΑΛΑΙΟ |
Εφαρμογή της εξίσωσης Nernst στον υπολογισμό του δυναμικού ημιστοιχείου

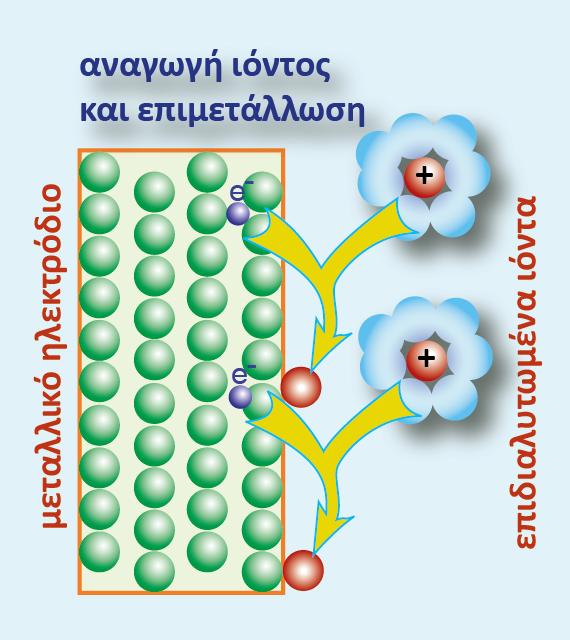
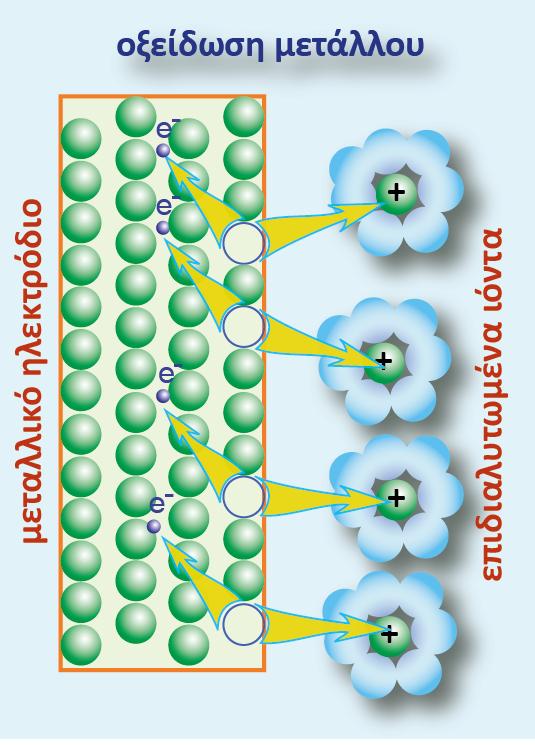
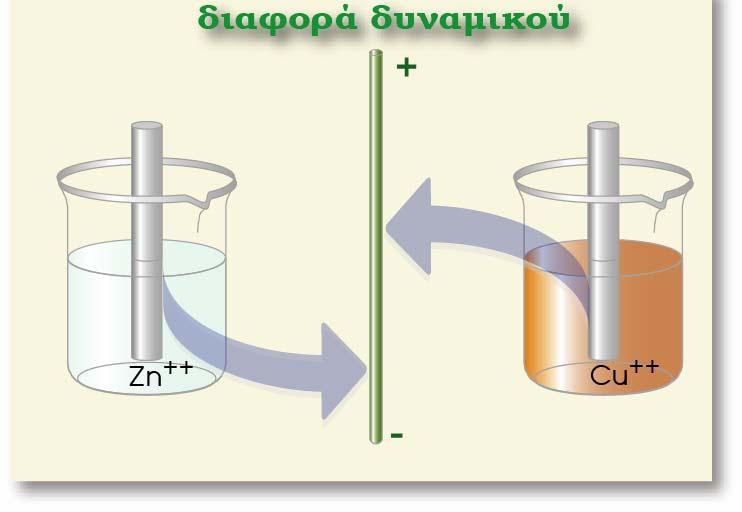
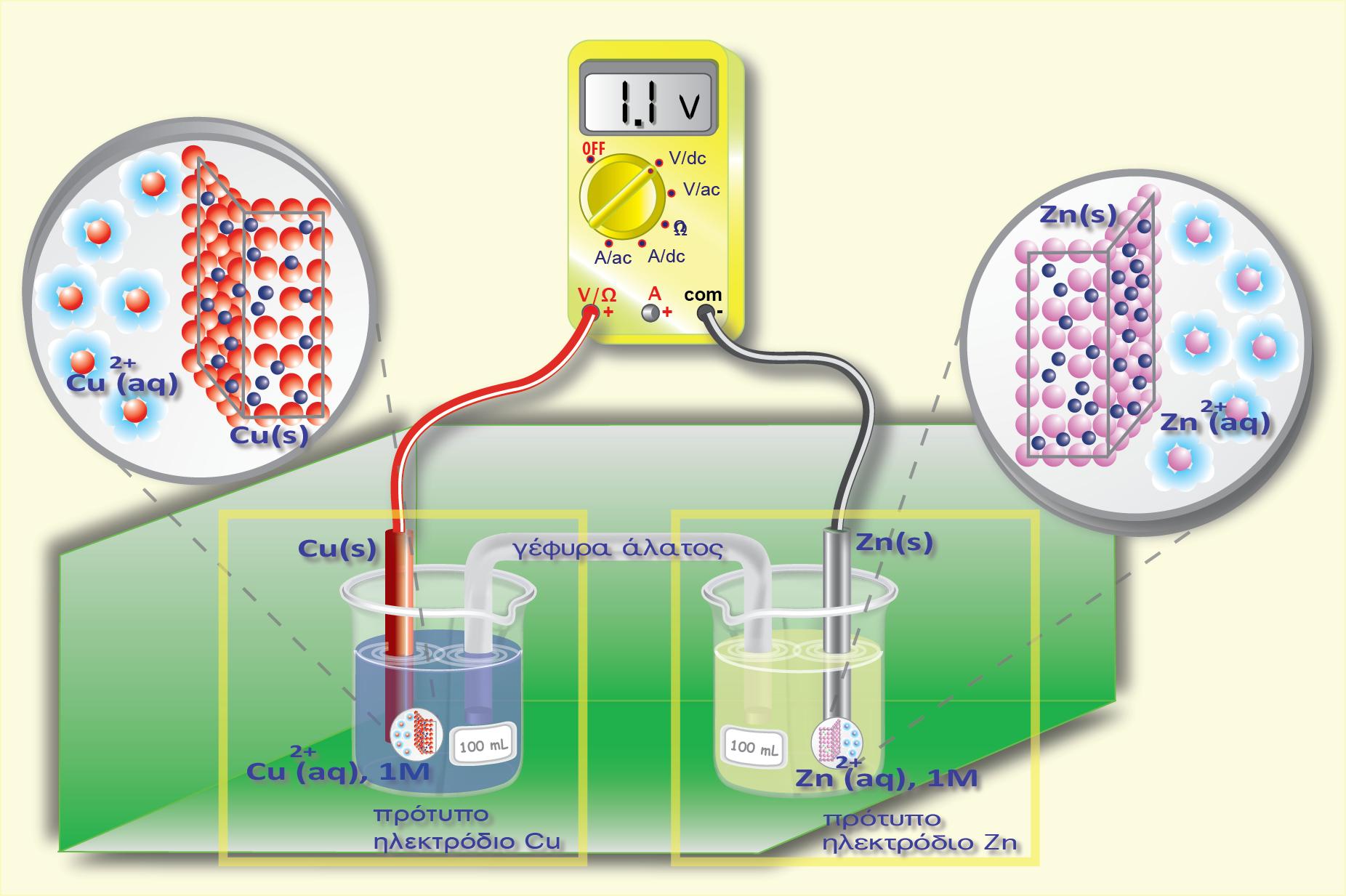
Ας μελετήσουμε το ημιστοιχείο του Zn [Zn(s)?Zn2+(aq)]. Ο Zn αποτελεί την αναγμένη μορφή (Red) και το κατιόν Zn2+ την οξειδωμένη μορφή (Ox).
2+
-
Zn(aq) + 2e
Ζn(s)
Επειδή ο Zn είναι σε στερεά μορφή (μεταλλική ράβδος), η συγκέντρωσή του θεωρείται ότι είναι 1 Μ, δηλαδή [Red] = 1M. Επίσης από την παραπάνω αντίδραση που πραγματοποιείται στο ημιστοιχείο προκύπτει ότι ανταλλάσσονται 2 e μεταξύ οξειδωμένης και αναγμένης μορφής (δηλαδή n =2). Με εφαρμογή της εξίσωσης Nernst για το ημιστοιχείο που μελετάμε προκύπτει η σχέση:
Από τους πίνακες των κανονικών δυναμικών, προκύπτει ότι το κανονικό δυναμικό του ημιστοιχείου του Zn (θ=250 C, [Zn2+] = 1 Μ), είναι E0 = ? 0,76 V.
Με αντικατάσταση στην προηγούμενη σχέση προκύπτει:
? Αύξηση της συγκέντρωσης του άλατος: αν αυξήσουμε τη συγκέντρωση του άλατος π.χ. [Zn2+] = 10 M, τότε από την προηγούμενη σχέση προκύπτει:
και επειδή log10=1
Παρατηρούμε ότι με αύξηση της συγκέντρωσης του άλατος στο 10 Μ, αυξάνεται το δυναμικό του ημιστοιχείου (δηλαδή γίνεται περισσότερο θετικό) 0,059 κατά την ποσότητα 2 .
Γενικά, αν η συγκέντρωση του άλατος είναι [Zn2+] = 10+α Μ, τότε για το δυναμικό του ημιστοιχείου θα ισχύει:
Δηλαδή αν η συγκέντρωση του άλατος από 1 Μ γίνει 10+α, αυξάνεται το δυναμικό του ημιστοιχείου (δηλαδή γίνεται περισσότερο θετικό) κατά την ποσότητα (0,059/2.α) ? 0,03.α.
+2
Zn Zn 1 Μ
-0,76 V
+2
Zn Zn 10 Μ
-0,73 V
Zn Zn 10 Μ+α
+2
-0,76+0,03.α V
? Μείωση της συγκέντρωσης του άλατος: αν μειώσουμε τη συγκέντρωση του άλατος π.χ. [Zn2+] = 10-1 M, τότε από την εξίσωση Nernst προκύπτει:
-1
E =-0,76+ 0,059 log10 = -0,76 - 0,059
2
2
=-0,79
Παρατηρούμε ότι με μείωση της συγκέντρωσης του άλατος στο 0,1 Μ, μειώνεται το δυναμικό του ημιστοιχείου (δηλαδή γίνεται περισσότερο αρνητικό) κατά την ποσότητα (0,059/2).
Γενικά, αν η συγκέντρωση του άλατος γίνει [Zn2+] δυναμικό του ημιστοιχείου θα ισχύει:
= 10-α Μ, τότε για το
Δηλαδή αν η συγκέντρωση του άλατος από 1Μ γίνει 10-α, μειώνεται το δυναμικό του ημιστοιχείου (δηλαδή γίνεται περισσότερο αρνητικό)κατά την ποσότητα (0,059/2).α ? 0,03.α
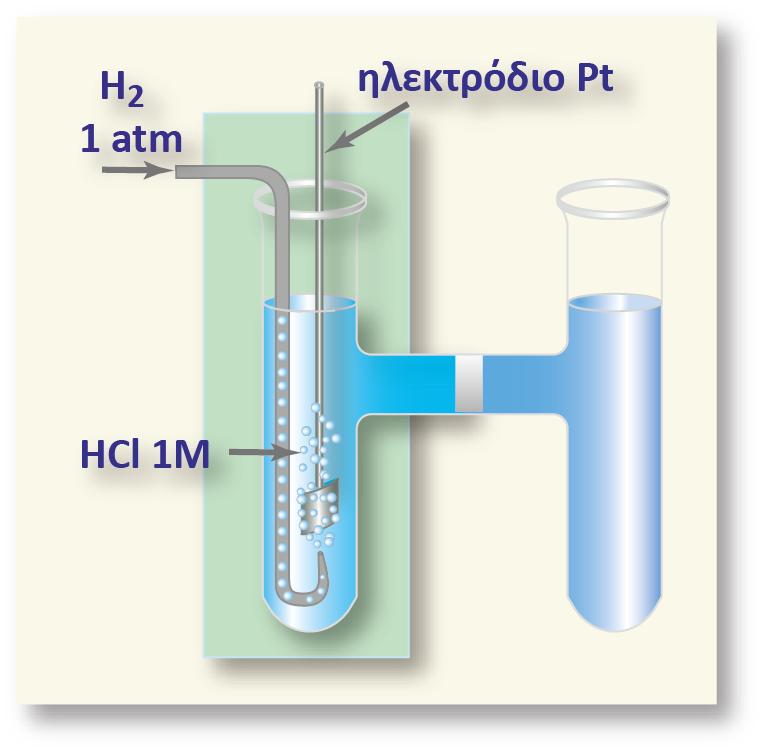
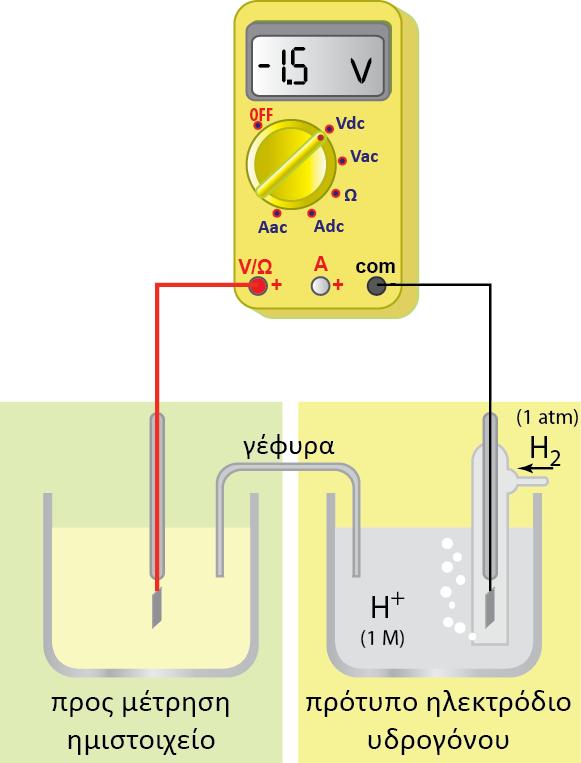
Επίδραση της συγκέντρωσης των κατιόντων Η+ στο δυναμικό του ηλεκτροδίου του υδρογόνου
Όπως αναφέραμε και παραπάνω, η τιμή του δυναμικού οξειδοαναγωγής (Ε) σε σχέση με το κανονικό δυναμικό οξειδοαναγωγής (Ε0) δίνεται από την εξίσωση:
Επειδή για το πρότυπο ηλεκτρόδιο του υδρογόνου κατά σύμβαση ισχύει Ε0=0 , o αριθμός των e που ανταλλάσσονται είναι n=1 και [Ox] =[Η+] τελικά προκύπτει η σχέση:
η οποία δίνει το δυναμικό ενός οποιουδήποτε ηλεκτροδίου υδρογόνου σε συνάρτηση με τη συγκέντρωσή του.
Έτσι , από την παραπάνω σχέση:
? για το πρότυπο ηλεκτρόδιο του Υδρογόνου επειδή [Η+] = 1Μ, προκύπτει:
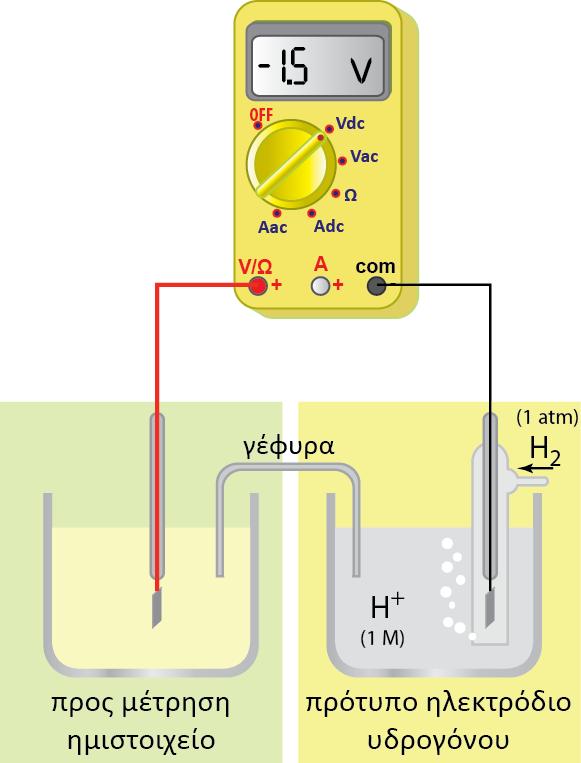
? για το ηλεκτρόδιο του Υδρογόνου με [Η+] = 0,1Μ= 10-1Μ προκύπτει:
? για το ηλεκτρόδιο του Υδρογόνου με [Η+] =10-7Μ προκύπτει:
? για το ηλεκτρόδιο του Υδρογόνου με [Η+] =10-14Μ προκύπτει:
| Προηγούμενο Αρθρο | Επόμενο Αρθρο |
| 4.1 ΕΞΙΣΩΣΗ Nernst | 5 ΚΕΦΑΛΑΙΟ |