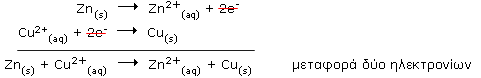- ΑΡΧΗ
- ΕΞΕΛΙΞΗ ΤΩΝ ΑΝΤΙΛΗΨΕΩΝ
- ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ
- ΑΝΤΙΔΡΑΣΕΙΣ ΑΠΛΗΣ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ
- ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ
- ΣΥΓΧΡΟΝΕΣ ΑΝΤΙΛΗΨΕΙΣ
- ΟΞΕΙΔΩΤΙΚΑ ΚΑΙ ΑΝΑΓΩΓΙΚΑ ΜΕΣΑ
- ΙΣΟΣΤΑΘΜΙΣΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
- ΑΥΘΟΡΜΗΤΕΣ ΚΑΙ ΜΗ ΑΥΘΟΡΜΗΤΕΣ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
- ΒΙΒΛΙΟΓΡΑΦΙΑ
ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ Βασικές έννοιες |
||||||
|
Πείραμα
Ερμηνεία: Αρχικά, έχουμε κόκκους ψευδαργύρου σε επαφή με ένα υδατικό διάλυμα CuSO4. Στο ψευδάργυρο τα άτομα ενώνονται μεταξύ τους με μεταλλικό δεσμό και, συνεπώς, τα ηλεκτρόνια της εξωτερικής τους στιβάδας είναι χαλαρά συνδεδεμένα. Ο θειικός χαλκός (ΙΙ) είναι ισχυρός ηλεκτρολύτης και στο διάλυμα υπάρχουν ελεύθερα θειικά ανιόντα και κατιόντα χαλκού (ΙΙ): CuSO4(s) Τα ιόντα αυτά κινούνται μέσα στο διάλυμα και, κατά την κίνησή τους, συγκρούονται και με τα άτομα της επιφάνειας των κόκκων ψευδαργύρου. Φαίνεται, λοιπόν, ότι, κατά τις συγκρούσεις των ιόντων με τα άτομα του ψευδαργύρου, συμβαίνουν ταυτόχρονα δύο φαινόμενα:
Καθώς προχωράει η αντίδραση, τα κατιόντα Zn2+ αντικαθιστούν τα κατιόντα Cu2+ στο διάλυμα και το διάλυμα αποχρωματίζεται, ενώ ο μεταλλικός χαλκός, που αρχικά συσσωρεύεται στην επιφάνεια των κόκκων του ψευδαργύρου, πέφτει ως ίζημα. Ορισμοί Κατά τη διάρκεια μιας οξειδοαναγωγικής αντίδρασης συμβαίνουν παράλληλα δύο επιμέρους φαινόμενα:
Τα δύο αυτά φαινόμενα γίνονται πάντοτε ταυτόχρονα και σε αλληλεξάρτηση μια και τα ηλεκτρόνια δεν είναι δυνατό να παραμένουν ελεύθερα σε διάλυμα. Έτσι, είναι λογικό να μιλάει κανείς για αντιδράσεις οξειδοαναγωγής, όταν αναφέρεται σε αντιδράσεις οι οποίες γίνονται με μεταφορά ηλεκτρονίων. Η χημική εξίσωση, που περιγράφει συνολικά το φαινόμενο, προκύπτει από την αλγεβρική πρόσθεση των δύο παραπάνω ημιαντιδράσεων:
Στη χημική αυτή εξίσωση, τα θειικά ανιόντα παραλείπονται και αναγράφονται μόνο τα χημικά είδη (άτομα, ιόντα) που συμμετέχουν στο μηχανισμό της αντίδρασης.
ιοντική αντίδραση: Zn(s) + Cu2+(aq) μοριακή αντίδραση: Zn(s) + CuSO4(aq) |
||||||
ΔιχηΝΕΤ 2007