- ΑΡΧΗ
- ΕΞΕΛΙΞΗ ΤΩΝ ΑΝΤΙΛΗΨΕΩΝ
- ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ
- ΑΝΤΙΔΡΑΣΕΙΣ ΑΠΛΗΣ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ
- ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ
- ΣΥΓΧΡΟΝΕΣ ΑΝΤΙΛΗΨΕΙΣ
- ΟΞΕΙΔΩΤΙΚΑ ΚΑΙ ΑΝΑΓΩΓΙΚΑ ΜΕΣΑ
- ΙΣΟΣΤΑΘΜΙΣΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
- ΑΥΘΟΡΜΗΤΕΣ ΚΑΙ ΜΗ ΑΥΘΟΡΜΗΤΕΣ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
- ΒΙΒΛΙΟΓΡΑΦΙΑ
|
ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ Οξειδοαναγωγικές αντιδράσεις σύνθεσης και διάσπασης |
||||
|
Οξειδοαναγωγικές αντιδράσεις σύνθεσης
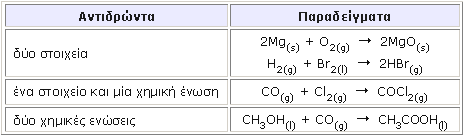
*source: //cwx.prenhall.com/petrucci/ medialib/media_portfolio/text_images/021_SODIUMCHLOR.MOV Γενικά, στις αντιδράσεις σύνθεσης, δύο (ή μερικές φορές τρία) αντιδρώντα ενώνονται έτσι, ώστε να σχηματίσουν ένα και μόνο προϊόν κατά το γενικό σχήμα: Αντιδρών(1) + Αντιδρών(2) Στην περίπτωση αυτή, τα αντιδρώντα μπορεί να είναι:
Αρκετές από τις αντιδράσεις αυτές παρουσιάζουν ιδιαίτερο βιομηχανικό ενδιαφέρον, όπως για παράδειγμα η σύνθεση της αμμωνίας από τα συστατικά της στοιχεία, το άζωτο και το υδρογόνο: Ν2(g) + 3Η2(g) Στη βιομηχανία, η σύνθεση της αμμωνίας πραγματοποιείται με τη μέθοδο Haber - Bosch, σε θερμοκρασία από 400 μέχρι 500 οC, πίεση 300 bar, παρουσία σιδήρου ως καταλύτη. Η αντίδραση είναι ιδιαίτερα σημαντική, επειδή η αμμωνία αποτελεί την πρώτη ύλη για την παρασκευή πολλών αζωτούχων χημικών προϊόντων, όπως τα αζωτούχα λιπάσματα και το νιτρικό οξύ. Εκτιμάται ότι η παγκόσμια παραγωγή αμμωνίας αγγίζει τους 150 εκατομμύρια τόνους ετησίως. Οξειδοαναγωγικές αντιδράσεις αποσύνθεσης και διάσπασης
Γενικά, στις αντιδράσεις αποσύνθεσης και διάσπασης μια χημική ένωση διασπάται σε απλούστερες ουσίες, που μπορεί να είναι (αντιδράσεις αποσύνθεσης) ή όχι (αντιδράσεις διάσπασης) τα συστατικά της στοιχεία σύμφωνα με το γενικό σχήμα: Αντιδρών Στις αντιδράσεις αυτές έχουμε διάσπαση χημικών δεσμών και γι’ αυτό γίνονται πάντοτε μόνο με απορρόφηση ενέργειας. Η ενέργεια που απαιτείται μπορεί να δοθεί με τη μορφή: α) θερμότητας (θερμική αποσύνθεση ή διάσπαση), β) ηλεκτρισμού (ηλεκτρόλυση) ή γ) φωτός (φωτόλυση). |
ΔιχηΝΕΤ 2007