- ΑΡΧΗ
- ΕΞΕΛΙΞΗ ΤΩΝ ΑΝΤΙΛΗΨΕΩΝ
- ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ
- ΑΝΤΙΔΡΑΣΕΙΣ ΑΠΛΗΣ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ
- ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ
- ΣΥΓΧΡΟΝΕΣ ΑΝΤΙΛΗΨΕΙΣ
- ΟΞΕΙΔΩΤΙΚΑ ΚΑΙ ΑΝΑΓΩΓΙΚΑ ΜΕΣΑ
- ΙΣΟΣΤΑΘΜΙΣΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
- ΑΥΘΟΡΜΗΤΕΣ ΚΑΙ ΜΗ ΑΥΘΟΡΜΗΤΕΣ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
- ΒΙΒΛΙΟΓΡΑΦΙΑ
|
ΣΥΓΧΡΟΝΕΣ ΑΝΤΙΛΗΨΕΙΣ Πολύπλοκες οξειδοαναγωγικές αντιδράσεις |
||||||
|
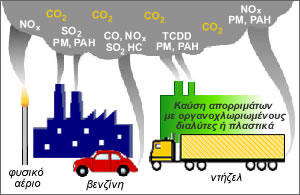
Σε πολύπλοκες οξειδοαναγωγικές αντιδράσεις στηρίζονται πολλές από τις διεργασίες που εφαρμόζονται στη βιομηχανία για την παρασκευή διαφόρων ανόργανων και οργανικών χημικών ενώσεων, καθώς και η δράση πολλών σκευασμάτων (φάρμακα, λευκαντικά, απολυμαντικά, κ.ά.). Το ίδιο ισχύει και σε ορισμένες περιπτώσεις χημικής ή ηλεκτροχημικής διάβρωσης των μετάλλων, με χαρακτηριστικό παράδειγμα τη διάβρωση του σιδήρου (σκούριασμα) από το οξυγόνο του αέρα. Χαρακτηριστικές περιπτώσεις οξειδοαναγωγικών αντιδράσεων πολύπλοκης μορφής αποτελούν: Οι αντιδράσεις των μετάλλων με τα οξειδωτικά οξέα *source:www.chemistrycoach.com.au/spontaneous_reaction.avi Κατά την επίδραση πυκνού διαλύματος νιτρικού οξέος σε μεταλλικό υδράργυρο, ο υδράργυρος οξειδώνεται προς νιτρικό υδράργυρο (ΙΙ), Hg(NO3)2, ενώ το ΗNO3 ανάγεται προς αέριο διοξείδιο του αζώτου, ΝΟ2, καστανού χρώματος: Hg(s) + 4ΗNO3(πυκνό) Το νιτρικό οξύ σε αραιό ή πυκνό διάλυμα και το θειικό οξύ σε πυκνό διάλυμα χαρακτηρίζονται ως οξειδωτικά οξέα και είναι ισχυρά οξειδωτικά μέσα. Έτσι, μπορούν να οξειδώσουν όλα τα μέταλλα, εκτός από το χρυσό και το λευκόχρυσο, προς τα αντίστοιχα νιτρικά και θειικά άλατα, όπου το μέταλλο έχει συνήθως το μεγαλύτερο αριθμό οξείδωσης. Ο χρυσός και ο λευκόχρυσος οξειδώνονται μόνο από το «βασιλικό νερό», ένα μίγμα από ΗNO3 και HCl με αναλογία moles 3:1. Το «βασιλικό νερό» οξειδώνει όλα τα μέταλλα προς τα αντίστοιχα χλωριούχα άλατα, όπου το μέταλλο έχει το μεγαλύτερο αριθμό οξείδωσης, ενώ παράλληλα εκλύεται και μονοξείδιο του αζώτου, π.χ.: Au(s) + HNO3(aq) + 3HCl(aq) Οι καύσεις των χημικών ενώσεων Σε αντίθεση με τις καύσεις των στοιχείων, που ανήκουν στις αντιδράσεις σύνθεσης, οι καύσεις των χημικών ενώσεων ανήκουν στην κατηγορία των πολύπλοκων οξειδοαναγωγικών αντιδράσεων. Γενικά, καύση είναι η αντίδραση μιας χημικής ουσίας (ανόργανης ή οργανικής) με το οξυγόνο που συνοδεύεται από την απελευθέρωση σημαντικών ποσών θερμότητας και φωτός. Χαρακτηριστικές περιπτώσεις αποτελούν οι καύσεις των οργανικών ουσιών που περιέχουν τα διάφορα καύσιμα, τα οποία χρησιμοποιούμε για θέρμανση και παραγωγή ενέργειας.
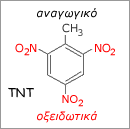
C3H8(g) + 3O2(g) Οι χημικές εκρήξεις Τα πιο γνωστά χημικά εκρηκτικά, όπως η νιτρογλυκερίνη και το τρινιτροτολουόλιο (ΤΝΤ), είναι οργανικές ενώσεις που περιέχουν ισχυρές οξειδωτικές και αναγωγικές ομάδες στο ίδιο μόριο. Yπάρχουν, όμως, και αρκετά, τα οποία είναι μίγματα ενός οξειδωτικού και ενός αναγωγικού μέσου.
4C3H5(ΟNO2)3(l) Σε μια τέτοια έκρηξη, ο όγκος των αερίων που παράγονται μπορεί να είναι ακόμη και 20.000 φορές μεγαλύτερος από τον αρχικό όγκο της νιτρογλυκερίνης. Τα χημικά εκρηκτικά χρησιμοποιούνται στα λατομεία και τα ορυχεία, στη διάνοιξη σηράγγων για τα μεταφορικά μέσα, για τη διάνοιξη θεμελίων και την καταστροφή παλαιών κτηρίων στις κατασκευές και για πολεμικούς σκοπούς. |
ΔιχηΝΕΤ 2007