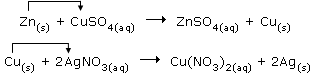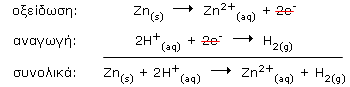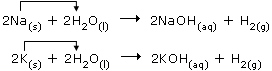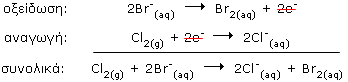- ΑΡΧΗ
- ΕΞΕΛΙΞΗ ΤΩΝ ΑΝΤΙΛΗΨΕΩΝ
- ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ
- ΑΝΤΙΔΡΑΣΕΙΣ ΑΠΛΗΣ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ
- ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ
- ΣΥΓΧΡΟΝΕΣ ΑΝΤΙΛΗΨΕΙΣ
- ΟΞΕΙΔΩΤΙΚΑ ΚΑΙ ΑΝΑΓΩΓΙΚΑ ΜΕΣΑ
- ΙΣΟΣΤΑΘΜΙΣΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
- ΑΥΘΟΡΜΗΤΕΣ ΚΑΙ ΜΗ ΑΥΘΟΡΜΗΤΕΣ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
- ΒΙΒΛΙΟΓΡΑΦΙΑ
|
ΑΝΤΙΔΡΑΣΕΙΣ ΑΠΛΗΣ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ Περιπτώσεις αντιδράσεων απλής αντικατάστασης |
||||||||||
1. Απλή αντικατάσταση μετάλλου από μέταλλο Χαρακτηριστικά παραδείγματα αποτελούν οι αντιδράσεις του Zn με υδατικό διάλυμα CuSO4 και του Cu με υδατικό διάλυμα AgNO3. Στις αντιδράσεις αυτές, ένα μέταλλο, που βρίσκεται σε ελεύθερη κατάσταση (Zn, Cu), αντικαθιστά ένα άλλο μέταλλο (Cu, Ag), που βρίσκεται σε μία χημική ένωση:
2. Απλή αντικατάσταση του υδρογόνου των οξέων από μέταλλο
Ερμηνεία: Το υδροχλωρικό οξύ είναι ισχυρό οξύ και σε διάλυμα βρίσκεται με τη μορφή κατιόντων υδρογόνου και ανιόντων χλωρίου: HCl(aq) Φαίνεται, λοιπόν, ότι, κατά τις συγκρούσεις των κατιόντων υδρογόνου με τα άτομα της μεταλλικής επιφάνειας, τα άτομα του μετάλλου αποβάλλουν ηλεκτρόνια (οξείδωση) και μετατρέπονται σε ανιόντα, τα οποία περνάνε στο διάλυμα, ενώ τα κατιόντα υδρογόνου, που τα προσλαμβάνουν (αναγωγή), ενώνονται ανά δύο μεταξύ τους σχηματίζοντας μόρια στοιχειακού υδρογόνο, το οποίο εκλύεται στο περιβάλλον, π.χ.:
Παρατηρήσεις: Ορισμένα μέταλλα, όπως ο χαλκός, ο υδράργυρος και τα ευγενή μέταλλα (Ag, Pt, Au), δεν αντιδρούν με το υδροχλωρικό οξύ, αντιδρούν όμως με το νιτρικό οξύ (HNO3) και το πυκνό θειικό οξύ (H2SO4). Γενικά, τα μέταλλα δε δίνουν αντιδράσεις απλής αντικατάστασης με όλα τα οξέα. Το νιτρικό και το πυκνό θειικό οξύ αντιδρούν με διαφορετικό τρόπο με τα μέταλλα. Οι αντιδράσεις αυτές είναι οξειδοαναγωγικές αντιδράσεις «πολύπλοκης μορφής» και όχι απλής αντικατάστασης. 3. Απλής αντικατάσταση του υδρογόνου του νερού από μέταλλο
*source: www.cci.ethz.ch/mainmov.html?expnum=115&ismovie=0&picnum=/007_SODIUMANDPO.MOV Γενικά, τα πιο ηλεκτροθετικά μέταλλα (Li, K, Ba, Sr, Ca, Na) αντιδρούν κατά το ίδιο σχήμα. Αντίθετα, ορισμένα λιγότερο ηλεκτροθετικά μέταλλα (π.χ. Mg, Al, Zn, Fe) δεν αντιδρούν με το νερό, αλλά μόνο με υδρατμούς σε υψηλή θερμοκρασία σχηματίζοντας τα αντίστοιχα μεταλλικά οξείδια και ελευθερώνοντας υδρογόνο, π.χ:
Τέλος, υπάρχουν και αρκετά μέταλλα (Co, Sn, Cu, Ag, κ.ά.) που δεν αντιδρούν ούτε με το νερό ούτε με υδρατμούς σε υψηλή θερμοκρασία. 4. Απλής αντικατάσταση αμετάλλου από αμέταλλο
Βιομηχανική παρασκευή βρωμίου
Στην αντίδραση αυτή, ένα αμέταλλο σε ελεύθερη κατάσταση (το Cl) αντικαθιστά ένα άλλο αμέταλλο (το Br) σε ενώσεις του, που είναι διαλυμένες σε νερό, είναι δηλαδή μία αντίδραση απλής αντικατάστασης. |
ΔιχηΝΕΤ 2007