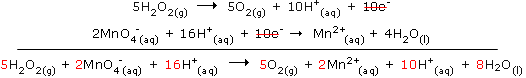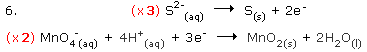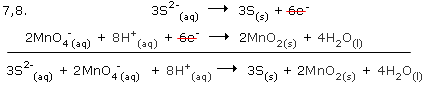- ΑΡΧΗ
- ΕΞΕΛΙΞΗ ΤΩΝ ΑΝΤΙΛΗΨΕΩΝ
- ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ
- ΑΝΤΙΔΡΑΣΕΙΣ ΑΠΛΗΣ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ
- ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ
- ΣΥΓΧΡΟΝΕΣ ΑΝΤΙΛΗΨΕΙΣ
- ΟΞΕΙΔΩΤΙΚΑ ΚΑΙ ΑΝΑΓΩΓΙΚΑ ΜΕΣΑ
- ΙΣΟΣΤΑΘΜΙΣΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
- ΑΥΘΟΡΜΗΤΕΣ ΚΑΙ ΜΗ ΑΥΘΟΡΜΗΤΕΣ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
- ΒΙΒΛΙΟΓΡΑΦΙΑ
|
ΙΣΟΣΤΑΘΜΙΣΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ Μέθοδος των ημιαντιδράσεων |
|
Σε όξινο διάλυμα Κατάστρωση ημιαντιδράσεων
Συνολική εξίσωση Για να βρούμε την τελική ισοσταθμισμένη ιοντική εξίσωση μιας οξειδοαναγωγικής αντίδρασης, όπως π.χ. αυτής ανάμεσα στo υπεροξείδιο του υδρογόνου και τα υπερμαγγανικά ιόντα:
Στο τέλος πάντα ελέγχουμε, αν η συνολική εξίσωση είναι πράγματι ισοσταθμισμένη. Παραδείγματος χάρη η παραπάνω αντίδραση είναι ορθή, επειδή υπάρχει ισοστάθμιση ατόμων και τα φορτία είναι +4 σε κάθε πλευρά της αντίδρασης. Σε βασικό διάλυμα Για την ισοστάθμιση των οξειδοαναγωγικών αντιδράσεων σε βασικό διάλυμα απαιτούνται ορισμένα πρόσθετα βήματα. Στην περίπτωση αυτή, αρχικά ισοσταθμίζουμε την αντίδραση σαν αυτή να γινόταν σε όξινο περιβάλλον (βήματα 1 έως 8) και στη συνέχεια:
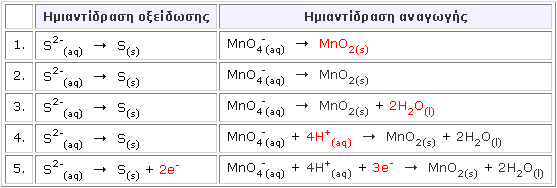
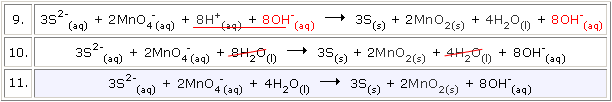
Παράδειγμα: Σε ασθενώς βασικά διαλύματα, τα θειούχα ανιόντα μετατρέπονται σε στοιχειακό θείο από τα υπερμαγγανικά ιόντα, τα οποία μετατρέπονται σε διοξείδιο του μαγγανίου κατά το σχήμα: S2-(aq) + MnO4-(aq) Βήματα
Ελέγχουμε, αν η συνολική εξίσωση είναι πράγματι ισοσταθμισμένη, π.χ. η παραπάνω αντίδραση είναι ορθή, επειδή υπάρχει ισοστάθμιση ατόμων και τα φορτία είναι -8 σε κάθε πλευρά της αντίδρασης. |
ΔιχηΝΕΤ 2007