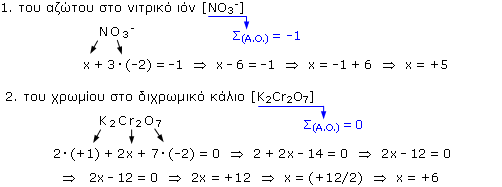- ΑΡΧΗ
- ΕΞΕΛΙΞΗ ΤΩΝ ΑΝΤΙΛΗΨΕΩΝ
- ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ
- ΑΝΤΙΔΡΑΣΕΙΣ ΑΠΛΗΣ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ
- ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ
- ΣΥΓΧΡΟΝΕΣ ΑΝΤΙΛΗΨΕΙΣ
- ΟΞΕΙΔΩΤΙΚΑ ΚΑΙ ΑΝΑΓΩΓΙΚΑ ΜΕΣΑ
- ΙΣΟΣΤΑΘΜΙΣΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
- ΑΥΘΟΡΜΗΤΕΣ ΚΑΙ ΜΗ ΑΥΘΟΡΜΗΤΕΣ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
- ΒΙΒΛΙΟΓΡΑΦΙΑ
|
ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ Εύρεση του αριθμού οξείδωσης |
||
|
Κανόνες Η εύρεση της οξειδωτικής κατάστασης ή αριθμού οξείδωσης του ατόμου ενός στοιχείου σε μία χημική ένωση ή ένα πολυατομικό ιόν στηρίζεται στους παρακάτω συμβατικούς κανόνες: 1. Κάθε στοιχείο σε ελεύθερη κατάσταση (Na, Cl2, P4, κ.ο.κ) έχει αριθμό οξείδωσης μηδέν. 2. Ο αριθμός οξείδωσης ενός μονοατομικού ιόντος είναι ίσος με το φορτίο του, π.χ. στα ιόντα Ca2+, Al3+ και Cl- οι Α.Ο. είναι αντίστοιχα +2, +3 και -1. 3. Το αλγεβρικό άθροισμα των αριθμών οξείδωσης όλων των ατόμων: 4. Τα μέταλλα έχουν πάντα θετικό αριθμό οξείδωσης. 5. Στις χημικές ενώσεις τους και τα πολυατομικά ιόντα, ο αριθμός οξείδωσης: Μέθοδος Συνήθως, για να υπολογίσουμε τον αριθμό οξείδωσης ενός στοιχείου σε μία χημική ένωση ή σε ένα πολυατομκό ιόν, ακολουθούμε την παρακάτω μέθοδο:
Παραδείγματα εύρεσης αριθμού οξείδωσης
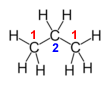
Κλασματικοί αριθμοί οξείδωσης Σε ορισμένες περιπτώσεις, μπορεί να προκύπτουν κλασματικοί αριθμοί οξείδωσης για ένα στοιχείο, π.χ. ο αριθμός οξείδωσης του άνθρακα στο προπάνιο (C3H8) είναι:
Αυτό συμβαίνει, γιατί όλα τα άτομα του στοιχείου στην ένωση ή το ιόν δεν εμφανίζουν την ίδια τιμή αριθμού οξείδωσης, οπότε η προσδιοριζόμενη τιμή δεν αντιπροσωπεύει παρά το μέσο όρο των διαφορετικών αυτών τιμών. Έτσι, αν γράψουμε το συντακτικό τύπο της ένωσης και υπολογίσουμε χωριστά τον αριθμό οξείδωσης κάθε ατόμου άνθρακα, θεωρώντας τον αριθμό οξείδωσης του άνθρακα σε σχέση με τον άνθρακα ίσο με μηδέν, προκύπτει ότι:
|
ΔιχηΝΕΤ 2007