- ΑΡΧΗ
- ΕΞΕΛΙΞΗ ΤΩΝ ΑΝΤΙΛΗΨΕΩΝ
- ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ
- ΑΝΤΙΔΡΑΣΕΙΣ ΑΠΛΗΣ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ
- ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ
- ΣΥΓΧΡΟΝΕΣ ΑΝΤΙΛΗΨΕΙΣ
- ΟΞΕΙΔΩΤΙΚΑ ΚΑΙ ΑΝΑΓΩΓΙΚΑ ΜΕΣΑ
- ΙΣΟΣΤΑΘΜΙΣΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
- ΑΥΘΟΡΜΗΤΕΣ ΚΑΙ ΜΗ ΑΥΘΟΡΜΗΤΕΣ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
- ΒΙΒΛΙΟΓΡΑΦΙΑ
|
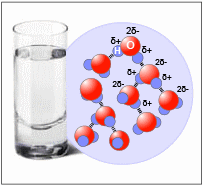
ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ Εισαγωγή της έννοιας της οξειδωτικής κατάστασης |
||||||
|
Ωστόσο, πολλές από τις αντιδράσεις σύνθεσης, που σύμφωνα με τις κλασικές αντιλήψεις είναι οξειδοαναγωγικές, αφορούν στο σχηματισμό ομοιοπολικών ενώσεων. Για παράδειγμα στην αντίδραση σύνθεσης του νερού από το υδρογόνο και το οξυγόνο: 2H2(g) + Ο2(g) το υδρογόνο αντιδρά με το οξυγόνο και επομένως οξειδώνεται, ενώ το οξυγόνο ενώνεται με το υδρογόνο και επομένως ανάγεται. Η αντίδραση αυτή, αν και ισχυρά εξώθερμη, έχει υψηλή ενέργεια ενεργοποίησης. Γι’ αυτό και συνήθως γίνεται παρουσία καταλύτη ή σε υψηλές θερμοκρασίες.
Επιπλέον, κάθε άτομο υδρογόνου αποτελείται από ένα πρωτόνιο και ένα ηλεκτρόνιο. Έτσι, θα μπορούσαμε να πούμε ότι στην περίπτωση αυτή τα ηλεκτρόνια των ατόμων του υδρογόνου μεταφέρονται μαζί με τα πρωτόνια στο οξυγόνο. Ωστόσο, με την κατάλληλη διάταξη, είναι δυνατό η μεταφορά των ηλεκτρονίων να διαχωριστεί από αυτήν των πρωτονίων. Αυτό επιτυγχάνεται στα στοιχεία καυσίμου, όπου τα πρωτόνια μεταφέρονται μέσω ενός ηλεκτρολύτη, ενώ τα ηλεκτρόνια μέσω ενός εξωτερικού αγωγού, με αποτέλεσμα την παραγωγή ηλεκτρικού ρεύματος. Τα παραπάνω δε σημαίνουν ότι οι οξειδοαναγωγικές αντιδράσεις που οδηγούν στο σχηματισμό ομοιοπολικών ενώσεων ή, κατ’ επέκταση, γίνονται αποκλειστικά ανάμεσα σε ομοιοπολικές ουσίες μπορούν να θεωρηθούν ως αντιδράσεις (πλήρους) μεταφοράς ηλεκτρονίων. Δείχνουν, ωστόσο, το γιατί οι χημικοί, αντί να διαχωρίσουν τις περιπτώσεις, θέλησαν να διευρύνουν την έννοια της οξειδοαναγωγής, ώστε να συμπεριλάβει όλες τις αντιδράσεις που σύμφωνα με τις κλασικές αντιλήψεις είναι οξειδοαναγωγικές. Αυτό έγινε με την εισαγωγή της έννοιας της οξειδωτικής κατάστασης ή αριθμού οξείδωσης ενός στοιχείου. |
ΔιχηΝΕΤ 2007