- ΑΡΧΗ
- ΕΞΕΛΙΞΗ ΤΩΝ ΑΝΤΙΛΗΨΕΩΝ
- ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ
- ΑΝΤΙΔΡΑΣΕΙΣ ΑΠΛΗΣ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ
- ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ
- ΣΥΓΧΡΟΝΕΣ ΑΝΤΙΛΗΨΕΙΣ
- ΟΞΕΙΔΩΤΙΚΑ ΚΑΙ ΑΝΑΓΩΓΙΚΑ ΜΕΣΑ
- ΙΣΟΣΤΑΘΜΙΣΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
- ΑΥΘΟΡΜΗΤΕΣ ΚΑΙ ΜΗ ΑΥΘΟΡΜΗΤΕΣ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
- ΒΙΒΛΙΟΓΡΑΦΙΑ
|
ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ Το οξειδοαναγωγικό ζεύγος |
||||
|
Το οξειδοαναγωγικό ζεύγος Cu2+(aq) / Cu(s) Cu2+(aq) + 2e- Απεναντίας, στην αντίδραση ανάμεσα στο μεταλλικό Cu και το διάλυμα AgNO3, ο μεταλλικός Cu οξειδώνεται προκαλώντας την οξείδωση των ιόντων αργύρου, δρα δηλαδή ως αναγωγικό: Cu(s) Επομένως, η ημιαντίδραση ανάμεσα στα ιόντα Cu2+ και το μεταλλικό Cu είναι δυνατή και προς τις δύο κατευθύνσεις, οπότε γράφουμε: Cu2+(aq) + 2e- και θεωρούμε ότι τα κατιόντα χαλκού (ΙΙ) και ο μεταλλικός χαλκός αποτελούν ένα συζυγές ζεύγος οξειδωτικού / αναγωγικού ή αλλιώς ένα οξειδοαναγωγικό ζεύγος. Το οξειδοαναγωγικό αυτό ζεύγος συμβολίζεται, κατά σύμβαση, γράφοντας αριστερά το οξειδωτικό: Cu2+(aq)/Cu(s). Γενικά Κάθε αναγωγικό (π.χ. Zn, Cu) αποβάλλοντας ηλεκτρόνια μετατρέπεται σε ένα σώμα, που μπορεί να προσλάβει ηλεκτρόνια (Zn2+, Cu2+), και επομένως, κάτω από ορισμένες συνθήκες, να δράσει ως οξειδωτικό. Αντιστρόφως, κάθε οξειδωτικό (π.χ. Cu2+, Ag+) προσλαμβάνοντας ηλεκτρόνια μετατρέπεται σε ένα σώμα, που μπορεί να διαθέσει ηλεκτρόνια (Cu, Ag), και συνεπώς, κάτω από ορισμένες προϋποθέσεις, να δράσει ως αναγωγικό. Λέμε ότι τα δύο αυτά μέσα αποτελούν ένα συζυγές ζεύγος οξειδωτικού/αναγωγικού ή αλλιώς ένα οξειδοαναγωγικό ζεύγος, που, στην πιο απλή περίπτωση, τα μέλη του συνδέονται με μία ημιαντίδραση της μορφής:
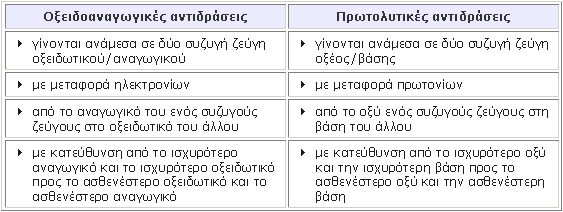
Οξειδοαναγωγικές και πρωτολυτικές αντιδράσεις Σε μία οξειδοαναγωγική αντίδραση, που γίνεται με μεταφορά ηλεκτρονίων:
Θεωρητικά, κάθε οξειδοαναγωγική αντίδραση είναι αμφίδρομη, γίνεται όμως αυθόρμητα προς την πλευρά που ευνοείται η μεταφορά των ηλεκτρονίων, δηλαδή με κατεύθυνση από το ισχυρότερο αναγωγικό και το ισχυρότερο οξειδωτικό προς το ασθενέστερο οξειδωτικό και το ασθενέστερο αναγωγικό. Τα παραπάνω δείχνουν ότι υπάρχει αναλογία ανάμεσα στις οξειδοαναγωγικές αντιδράσεις που γίνονται με μεταφορά ηλεκτρονίων και στις πρωτολυτικές αντιδράσεις της θεωρίας των Brönsted – Lowry, οι οποίες γίνονται με μεταφορά πρωτονίων (Η+), π.χ.:
Πίνακας: Αναλογίες ανάμεσα στις οξειδοαναγωγικές αντιδράσεις
|
ΔιχηΝΕΤ 2007