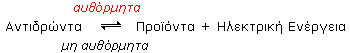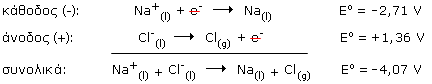- ΑΡΧΗ
- ΕΞΕΛΙΞΗ ΤΩΝ ΑΝΤΙΛΗΨΕΩΝ
- ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ
- ΑΝΤΙΔΡΑΣΕΙΣ ΑΠΛΗΣ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ
- ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ
- ΣΥΓΧΡΟΝΕΣ ΑΝΤΙΛΗΨΕΙΣ
- ΟΞΕΙΔΩΤΙΚΑ ΚΑΙ ΑΝΑΓΩΓΙΚΑ ΜΕΣΑ
- ΙΣΟΣΤΑΘΜΙΣΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
- ΑΥΘΟΡΜΗΤΕΣ ΚΑΙ ΜΗ ΑΥΘΟΡΜΗΤΕΣ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
- ΒΙΒΛΙΟΓΡΑΦΙΑ
|
ΑΥΘΟΡΜΗΤΕΣ ΚΑΙ ΜΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ Ηλεκτρόλυση |
||
Τα διάφορα γαλβανικά στοιχεία λειτουργούν με οξειδοαναγωγικές αντιδράσεις που είναι αυθόρμητες και οδηγούν στην παραγωγή ηλεκτρικού ρεύματος. Οι αντίστροφες όμως αντιδράσεις, σε κάθε περίπτωση, δεν είναι αυθόρμητες και γίνονται με παροχή ηλεκτρικής ενέργειας. Το γενικό σχήμα των οξειδοαναγωγικών αυτών αντιδράσεων είναι:
Η διεργασία, κατά την οποία χρησιμοποιείται ηλεκτρική ενέργεια για την πραγματοποίηση χημικών αντιδράσεων, ονομάζεται ηλεκτρόλυση. Η διέλευση, όμως, του ηλεκτρικού ρεύματος μέσα από τη μάζα ενός σώματος προϋποθέτει την ύπαρξη κατάλληλων ευκίνητων φορέων. Τέτοιοι φορείς είναι τα ελεύθερα ιόντα στο υδατικό διάλυμα ή το τήγμα ενός ηλεκτρολύτη. Με άλλα λόγια: «Hλεκτρόλυση είναι η διεργασία με την οποία μια μη αυθόρμητη αντίδραση υποχρεώνεται να λάβει χώρα ως αποτέλεσμα της διέλευσης ηλεκτρικού ρεύματος μέσα από το τήγμα ή το υδατικό διάλυμα ενός ηλεκτρολύτη». Τα ηλεκτρολυτικά στοιχεία Η ηλεκτρόλυση γίνεται μέσα σε ειδικές συσκευές, που ονομάζονται ηλεκτρολυτικά στοιχεία και, συνήθως, αποτελούνται από:
Για να γίνει ηλεκτρόλυση, πρέπει η τάση της πηγής να είναι κατά ένα ορισμένο ποσό μεγαλύτερη από αυτήν που παρέχει ένα γαλβανικό στοιχείο το οποίο λειτουργεί με την αντίστροφη (αυθόρμητη) αντίδραση. Τα ηλεκτρόδια, που μπορεί να είναι ράβδοι ή επιφάνειες, αφενός συνδέονται με τους πόλους της πηγής και αφετέρου βρίσκονται σε επαφή με το τήγμα ή το διάλυμα του ηλεκτρολύτη. Το ηλεκτρόδιο το οποίο συνδέεται με τον αρνητικό πόλο της πηγής αποτελεί την κάθοδο του ηλεκτρολυτικού στοιχείου, ενώ εκείνο που συνδέεται με τον θετικό πόλο της πηγής αποτελεί την άνοδο. Γενικά, είναι επιθυμητό τα ηλεκτρόδια να είναι αδρανή, δηλαδή να μην αντιδρούν με τον ηλεκτρολύτη ή τα προϊόντα της ηλεκτρόλυσης. Ως αδρανή ηλεκτρόδια χρησιμοποιούνται συνήθως ηλεκτρόδια από γραφίτη ή λευκόχρυσο. Λειτουργία των ηλεκτρολυτικών στοιχείων Κατά τη λειτουργία ενός ηλεκτρολυτικού στοιχείου, τα ηλεκτρόνια κατευθύνονται από τον αρνητικό πόλο της πηγής προς την κάθοδο του στοιχείου . Έτσι, η κάθοδος εμφανίζει περίσσεια ηλεκτρονίων και ασκεί έλξη στα κατιόντα του ηλεκτρολύτη που βρίσκονται γύρω από αυτή. Τα κατιόντα αυτά κινούνται προς την κάθοδο, όπου και εκφορτίζονται προσλαμβάνοντας ηλεκτρόνια. Αυτό δημιουργεί μία κλίση συγκέντρωσης γύρω από το ηλεκτρόδιο, οπότε νέα κατιόντα έρχονται με διάχυση στην περιοχή, τα οποία με τη σειρά τους έλκονται, οδεύουν προς την κάθοδο και εκφορτίζονται, κ.ο.κ. Σε αντίθεση με την κάθοδο, η άνοδος παρουσιάζει έλλειμμα ηλεκτρονίων και έλκει τα ανιόντα του ηλεκτρολύτη που βρίσκονται γύρω από αυτή. Τα ανιόντα αυτά κινούνται προς την άνοδο, όπου και εκφορτίζονται αποβάλλοντας ηλεκτρόνια. Αυτό δημιουργεί μία κλίση συγκέντρωσης γύρω από το ηλεκτρόδιο, οπότε νέα ανιόντα έρχονται με διάχυση στην περιοχή, τα οποία με τη σειρά τους έλκονται, οδεύουν προς την άνοδο και εκφορτίζονται, κ.ο.κ. Παράδειγμα: Χαρακτηριστικό παράδειγμα παραγωγής δραστικού μετάλλου με τη μέθοδο της ηλεκτρόλυσης είναι η παραγωγή του μεταλλικού νατρίου με ηλεκτρόλυση τήγματος χλωριούχου νατρίου. Το χλωριούχο νάτριο τήκεται στους 801 oC και στο τήγμα υπάρχουν ελεύθερα κατιόντα νατρίου και ανιόντα χλωρίου: NaCl(s)
Η συνολική αντίδραση κατά την ηλεκτρόλυση τήγματος χλωριούχου νατρίου είναι:
και η τάση που απαιτείται για την πραγματοποίηση της μεγαλύτερη από 4,07 V. Παρατήρηση: Στα υδατικά διαλύματα, εκτός από τα ιόντα του ηλεκτρολύτη, υπάρχουν και μόρια νερού. Το καθαρό νερό έχει πολύ μικρή συγκέντρωση σε ιόντα, [H+] = [OH-] = 10-7 M στους 25 oC, και δεν είναι καλός αγωγός του ηλεκτρικού ρεύματος. Με τη διάλυση, όμως, ενός ηλεκτρολύτη στο νερό, ελευθερώνονται ή σχηματίζονται ιόντα που μπορούν να δράσουν ως φορείς του ηλεκτρικού ρεύματος. Γι’ αυτό, είναι απαραίτητο, κάθε φορά, να εξετάζεται η δυνατότητα εμπλοκής του νερού στις δράσεις που γίνονται στα ηλεκτρόδια. Εφαρμογές Οι κλασικές εφαρμογές της ηλεκτρόλυσης αφορούν στην:
Σήμερα, η μέθοδος της ηλεκτρόλυση εφαρμόζεται επίσης και στη σύνθεση οργανικών ουσιών, στον καθαρισμό και στο διαχωρισμό τους από ηλεκτρολύτες, στην κατεργασία του νερού και των υγρών αποβλήτων, για την απομάκρυνση τοξικών ουσιών από το έδαφος, κ.λ.π. |
ΔιχηΝΕΤ 2007