- ΑΡΧΗ
- ΕΞΕΛΙΞΗ ΤΩΝ ΑΝΤΙΛΗΨΕΩΝ
- ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ
- ΑΝΤΙΔΡΑΣΕΙΣ ΑΠΛΗΣ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ
- ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ
- ΣΥΓΧΡΟΝΕΣ ΑΝΤΙΛΗΨΕΙΣ
- ΟΞΕΙΔΩΤΙΚΑ ΚΑΙ ΑΝΑΓΩΓΙΚΑ ΜΕΣΑ
- ΙΣΟΣΤΑΘΜΙΣΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
- ΑΥΘΟΡΜΗΤΕΣ ΚΑΙ ΜΗ ΑΥΘΟΡΜΗΤΕΣ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
- ΒΙΒΛΙΟΓΡΑΦΙΑ
|
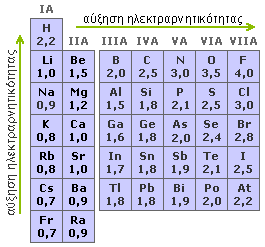
ΗΛΕΚΤΡΑΡΝΗΤΙΚΟΤΗΤΑ ΣΤΟΙΧΕΙΩΝ
|
|||
Ηλεκτραρνητικότητα και χημικοί δεσμοί Όταν τα άτομα ενώνονται μεταξύ τους, «ανταγωνίζονται» για τα ηλεκτρόνια των δεσμών που σχηματίζουν. Το άτομο με την μεγαλύτερη ηλεκτραρνητικότητα έλκει περισσότερο προς το μέρος του τα δεσμικά ηλεκτρόνια από το άτομο με τη χαμηλότερη ηλεκτραρνητικότητα. Ο βαθμός μετατόπισης των δεσμικών ηλεκτρονίων προς το πιο ηλεκτραρνητικό άτομο εξαρτάται από τη διαφορά ηλεκτραρνητικότητας ανάμεσα στα δύο άτομα. Όταν η διαφορά αυτή είναι σημαντική (>1,7), όπως συμβαίνει σε πολλές περιπτώσεις ένωσης ενός μετάλλου με ένα αμέταλλο, η μετατόπιση αυτή είναι πλήρης. Το μέταλλο χάνει τα ηλεκτρόνια σθένους, τα οποία προσλαμβάνει το αμέταλλο, με αποτέλεσμα τη δημιουργία ιόντων και, κατά συνέπεια, ιοντικών (κρυσταλλικών) στερεών ενώσεων, π.χ.:
Μικρότερες, όμως, διαφορές ηλεκραρνητικότητας, όπως π.χ. όταν ενώνονται δύο αμέταλλα, δεν οδηγούν σε απώλεια και πρόσληψη ηλεκτρονίων, αλλά μόνο σε μερική μετατόπιση του κοινού ή των κοινών ζευγών ηλεκτρονίων προς το πιο ηλεκτραρνητικό άτομο. Έτσι, δημιουργείται μια ασύμμετρη κατανομή φορτίου ανάμεσα στα άτομα, με αποτέλεσμα την εμφάνιση μερικού αρνητικού φορτίου στο πιο ηλεκτραρνητικό από αυτά και ισοδύναμου θετικού φορτίου στο λιγότερο ηλεκτραρνητικό και συνέπεια την πόλωση του ομοιοπολικού δεσμού, π.χ.:
Ηλεκτραρνητικότητα και αριθμός οξείδωσης Η οξειδωτική κατάσταση ή αλλιώς αριθμός οξείδωσης του ατόμου ενός στοιχείου σε ένα σωματίδιο (μόριο ή ιόν) αναφέρεται σε ένα ηλεκτρικό φορτίο. Το φορτίο αυτό συμπίπτει με το πραγματικό φορτίο του ατόμου μόνο στην περίπτωση των μονοατομικών ιόντων (Νa+, Mg2+, Al3+, κ.λ.π.) που συμμετέχουν σε έναν ιοντικό δεσμό. Σε όλες τις άλλες περιπτώσεις, ο αριθμός οξείδωσης δεν είναι παρά ένα καθαρά υποθετικό φορτίο, το οποίο αποδίδεται στο άτομο θεωρώντας όλους τους δεσμούς σαν ιοντικούς. Με άλλα λόγια, το φορτίο που θα είχε το άτομο, αν τα ηλεκτρόνια από κάθε δεσμό, στον οποίο συμμετέχει, αποδίδονταν εξ ολοκλήρου στο πιο ηλεκτραρνητικό άτομο, π.χ.:
Σύμφωνα με τα παραπάνω, για να βρούμε τους αριθμούς οξείδωσης των διαφόρων στοιχείων πρέπει να γνώριζουμε τόσο την τιμή ηλεκτραρνητικότητας όσο και την ηλεκτρονιακή τους δομή. Έτσι, για να βρούμε τον αριθμό οξείδωσης ενός στοιχείου σε μία ομοιοπολική ένωση ή ένα πολυατομικό ιόν, θα έπρεπε:
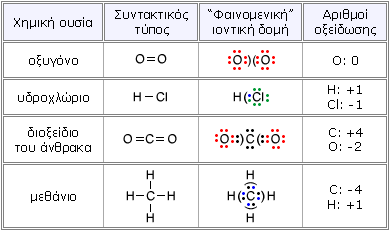 Στην πράξη, ωστόσο, ακολουθούμε μια πιο εύχρηστη και λιγότερο επίπονη διαδικασία η οποία στηρίζεται σε ορισμένους συμβατικούς κανόνες, που προκύπτουν με βάση τον ορισμό του αριθμού οξείδωσης και τις τιμές ηλεκτραρνητικότητας των στοιχείων. |
ΔιχηΝΕΤ 2007