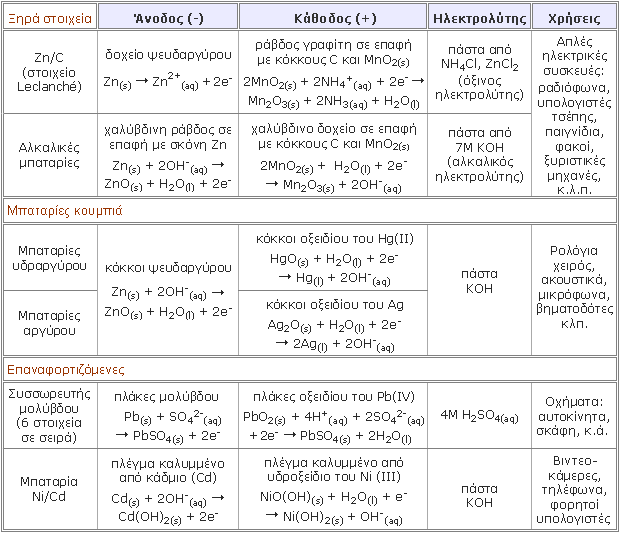
|
Οι μπαταρίες είναι πηγές ηλεκτρικού ρεύματος που μεταφέρονται εύκολα και αποτελούνται από ένα ή περισσότερα γαλβανικά στοιχεία. Στη δεύτερη περίπτωση, τα γαλβανικά στοιχεία είναι συνδεδεμένα σε σειρά και το συνολικό δυναμικό είναι ίσο με το άθροισμα των επιμέρους δυναμικών των στοιχείων.
Στα περισσότερα στοιχεία που χρησιμοποιούνται σήμερα στις μπαταρίες, ο ηλεκτρολύτης δε βρίσκεται σε υγρή μορφή, όπως στο στοιχείο Daniell, αλλά σε μορφή πάστας, γι’ αυτό και χαρακτηρίζονται ως ξηρά στοιχεία. Θεωρητικά, υπάρχουν πολλές οξειδοαναγωγικές αντιδράσεις, οι οποίες μπορούν να χρησιμοποιηθούν για την κατασκευή μπαταριών. Ωστόσο, λίγες μόνο από αυτές εφαρμόζονται στην πράξη.
Οι μπαταρίες διακρίνονται σε:
1. μπαταρίες πρώτου είδους, δηλαδή μπαταρίες μιας
χρήσεως, που αχρηστεύονται με την εκφόρτισή τους
2. μπαταρίες δευτέρου είδους,
οι οποίες μπορούν να
επαναφορτιστούν με τη διαβίβαση ηλεκτρικού
ρεύματος (μη αυθόρμητες αντιδράσεις). Έτσι, οι
χημικές δράσεις, που γίνονται κατά την εκφόρτιση,
αντιστρέφονται, οι αρχικές ουσίες επανασχηματίζονται
και η μπαταρία μπορεί να χρησιμοποιηθεί ξανά.
Ωστόσο, ένα μέρος της ενέργειας χάνεται κατά τους
κύκλους φόρτισης / εκφόρτισης, με αποτέλεσμα και
αυτές να έχουν μια ορισμένη διάρκεια ζωής. |