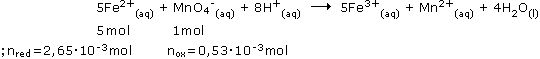- ΑΡΧΗ
- ΕΞΕΛΙΞΗ ΤΩΝ ΑΝΤΙΛΗΨΕΩΝ
- ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΜΕΤΑΦΟΡΑΣ ΗΛΕΚΤΡΟΝΙΩΝ
- ΑΝΤΙΔΡΑΣΕΙΣ ΑΠΛΗΣ ΑΝΤΙΚΑΤΑΣΤΑΣΗΣ
- ΟΞΕΙΔΩΤΙΚΗ ΚΑΤΑΣΤΑΣΗ Ή ΑΡΙΘΜΟΣ ΟΞΕΙΔΩΣΗΣ
- ΣΥΓΧΡΟΝΕΣ ΑΝΤΙΛΗΨΕΙΣ
- ΟΞΕΙΔΩΤΙΚΑ ΚΑΙ ΑΝΑΓΩΓΙΚΑ ΜΕΣΑ
- ΙΣΟΣΤΑΘΜΙΣΗ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
- ΑΥΘΟΡΜΗΤΕΣ ΚΑΙ ΜΗ ΑΥΘΟΡΜΗΤΕΣ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ
- ΒΙΒΛΙΟΓΡΑΦΙΑ
|
ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΗ ΤΙΤΛΟΔΟΤΗΣΗ
|
|||
Η οξειδοαναγωγική τιτλοδότηση είναι μία εργαστηριακή μέθοδος χημικής ανάλυσης, η οποία χρησιμοποιείται για τον προσδιορισμό της συγκέντρωσης ενός αναγωγικού ή οξειδωτικού μέσου (Α) σε ένα διάλυμα του. Για το σκοπό αυτό χρησιμοποιείται ένα διάλυμα γνωστής συγκέντρωσης ενός οξειδωτικού ή αναγωγικού μέσου αντίστοιχα (Β) με το οποίο η ουσία Α αντιδρά. Το δεύτερο αυτό διάλυμα χαρακτηρίζεται ως πρότυπο διάλυμα.
*animation source: http://ull.chemistry.uakron.edu/genobc/animations/titration.mov Πίνακας: Ορισμένες σημαντικές μέθοδοι οξειδοαναγωγικής τιτλοδότησης
Παράδειγμα: Μαγγανιομετρία Το υπερμαγγανικό κάλιο χρησιμοποιείται κυρίως σε όξινο με H2SΟ4 περιβάλλον για τη τιτλοδότηση διαλυμάτων αναγωγικών χωρίς να απαιτείται δείκτης. Ωστόσο, επειδή το τελικό προϊόν της αναγωγής των υπερμαγγανικών ανιόντων εξαρτάται από την οξύτητα του διαλύματος, θα πρέπει να εξασφαλίζονται συνθήκες σταθερού pΗ κατά τη διάρκεια της τιτλοδότησης. Η πιο συνηθισμένη εφαρμογή της έγκειται στον προσδιορισμό του σιδήρου στα σιδηρούχα ορυκτά ή κράματα και τα διαλυτά άλατά του από δείγματα οργανικής φύσης, σύμφωνα με τα παρακάτω:
Υπολογιστικό παράδειγμα: Έστω ότι δίνεται προς ανάλυση ένα άγνωστο διάλυμα κατιόντων Fe2+. 25 mL από το διάλυμα αυτό, μετρημένα ακριβώς με σιφώνιο ή προχοΐδα, μεταφέρονται σε κωνική φιάλη και αραιώνονται στα 100 mL με προσθήκη αποσταγμένου νερού. Στη συνέχεια προσθέτουμε 10 mL διαλύματος H2SO4 1 Μ και το διάλυμα τιτλοδοτείται με πρότυπο διάλυμα KMnΟ4 0,020 Μ. Έστω τώρα ότι κατά την τιτλοδότηση καταναλώθηκαν 26,5 mL διαλύματος KMnΟ4:
Παρατηρήσεις: Επειδή το υπερμαγγανικό κάλιο είναι ισχυρό οξειδωτικό, τα διαλύματά του δεν είναι σταθερά και απαιτούν κάθε φορά τιτλοδότηση για την εύρεση του ακριβούς τίτλου τους, πριν από την τιτλοδότηση του άγνωστου δείγματος. Γι’ αυτό και χαρακτηρίζονται ως δευτερογενή πρότυπα διαλύματα. Για τον ίδιο λόγο, πρέπει να διατηρούνται σε σκοτεινές φιάλες και να μην εκτίθενται στην ατμόσφαιρα. Η τιτλοδότηση των διαλυμάτων του υπερμαγγανικού καλίου γίνεται με πρότυπο διάλυμα αιθανοδιϊκού (οξαλικού) νατρίου σε όξινο με θειικό οξύ περιβάλλον και θερμοκρασίες που ξεπερνούν τους 70 oC, σύμφωνα με την αντίδραση: 2MnO4-(aq) + 5C2Ο42-(aq) + 16H+(aq) |
ΔιχηΝΕΤ 2007