

- ΟΞΕΙΔΟΑΝΑΓΩΓΗ
- Εισαγωγή
- Αριθμός οξείδωσης
- Οξείδωση-Αναγωγή
- Οξειδωτικά-Αναγωγικά
- Ημιαντιδράσεις οξείδωσης-αναγωγής
- Αντιδράσεις οξειδοαναγωγής με τη μέθοδο ημιαντιδράσεων
- ΙΔΙΟΤΗΤΕΣ ΜΕΤΑΛΛΩΝ-ΑΓΩΓΟΙ
- Εισαγωγή
- Δομή μεταλλικού πλέγματος
- Δραστικότητα μετάλλων
- Ηλεκτροδιαλυτική τάση μετάλλων
- Ηλεκτρικοί αγωγοί
- ΓΑΛΒΑΝΙΚΑ ΣΤΟΙΧΕΙΑ
- Εισαγωγή
- Γαλβανικά στοιχεία
- Ημιστοιχεία-Ε ημιστοιχείων
- Ε0 ημιστοιχείων
- Γέφυρα άλατος
- Συμβολισμός ημιστοιχείου-Ηλεκτρόδια ημιστοιχείων
- Συμβολισμός γαλβανικού στοιχείου
- Ε στοιχείου - Ε0 στοιχείου-Υπολογισμοί Ε0
- Γραφή συνολικής αντίδρασης στοιχείου
- Παραδείγματα γραφής στοιχείων
- ΔG οξειδοαναγωγικής αντίδρασης
- Εξίσωση Nerst
- Παραδείγματα χρήσης εξίσωσης Nerst
- Εφαρμογές στοιχείων -Μπαταρίες
- ΠΕΙΡΑΜΑ - Στοιχείο Daniell
- ΗΛΕΚΤΡΟΛΥΣΗ
- Ηλεκτρολυτικά στοιχεία
- Προϊόντα ηλεκτρόλυσης
- Σύγκριση γαλβανικού – ηλεκτρολυτικού στοιχείου
- Παραδείγματα ηλεκτρόλυσης
- Νόμοι Faraday
- ΠΕΙΡΑΜΑ - Ηλεκτρόλυση Η2Ο ή αρ.δ. H2SO4
2.2 Κρυσταλλική μεταλλική δομή
Η πιο συνηθισμένη δομή των μετάλλων επιτυγχάνεται με τη διαστρωμάτωση των σωματιδίων του μετάλλου σε όσο το δυνατόν περισσότερο συμπαγή μορφή.
Στην πρώτη επιφάνεια τοποθετούνται τα σωματίδια του μετάλλου δημιουργώντας το πρώτο στρώμα. Στη δεύτερη επιφάνεια τα σωματίδια τοποθετούνται μέσα στις κοιλότητες οι οποίες σχηματίζονται από τα σωματίδια του πρώτου στρώματος. Μ’ αυτό τον τρόπο συνεχίζεται η τοποθέτηση κι’ άλλων σωματιδιακών στρωμάτων ώστε τελικά να σχηματιστεί ο λεγόμενος μεταλλικός κρύσταλλος.
Μεταξύ αυτών των στρωμάτων δημιουργούνται οι λεγόμενοι μεταλλικοί δεσμοί.


Διαστρωμάτωση σωματιδίων του μετάλλου στο μεταλλικό πλέγμα

Διαστρωμάτωση ατόμων Na
Για να ερμηνευτεί η φύση του μεταλλικού δεσμού διατυπώθηκε από τον Η. Lorentz το 1900 η θεωρία των ελεύθερων ηλεκτρονίων. Σύμφωνα μ’ αυτή τη θεωρία, τα ηλεκτρόνια της εξωτερικής στιβάδας των ατόμων του μετάλλου θεωρούνται ελεύθερα, σαν ηλεκτρονιακό νέφος, τα οποία και κινούνται στο ηλεκτρικό πεδίο που δημιουργούν τα εναπομείναντα κατιόντα του κρυσταλλικού πλέγματος. Μεταξύ αυτών των ηλεκτρονίων και των κατιόντων του πλέγματος αναπτύσσονται ελκτικές δυνάμεις ηλεκτροστατικής φύσεως, οι οποίες είναι ικανές να συγκρατήσουν τις επιφάνειες τη μία κοντά στην άλλη.

Ελεύθερα ηλεκτρόνια στη δομή ενός μεταλλικού πλέγματος
Το κάθε είδος μετάλλου δημιουργεί έναν ειδικό τύπο κρυσταλλικού πλέγματος χαρακτηριστικής δομής. Έτσι για παράδειγμα η δομή του κρυσταλλικού πλέγματος του Zn και του Mg έχει μια χαρακτηριστική διάταξη επιφανειών ώστε να χαρακτηρίζεται ως εξαγωνική δομή πυκνής διάταξης (hexagonal closest-packed)

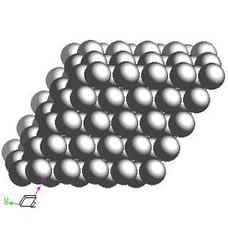
Δομή κρυσταλλικού πλέγματος Zn

Δομή κρυσταλλικού πλέγματος Mg
Η κρυσταλλική δομή των μετάλλων Cu, Ag, Au κ.ά. έχει μια τέτοια διαστρωμάτωση επιφανειών ώστε να χαρακτηρίζεται ως ενδοκεντρωμένο κυβικό κρυσταλλικό πλέγμα (face-centred cubic).
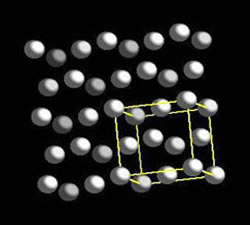

Δομή κρυσταλλικού πλέγματος Ag
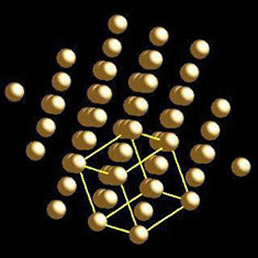

Δομή κρυσταλλικού πλέγματος Au
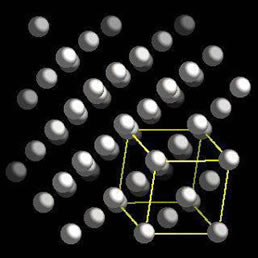

Δομή κρυσταλλικού πλέγματος Pt
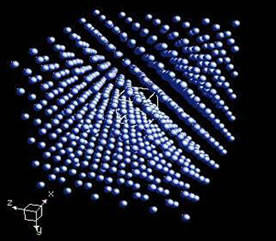

Δομή κρυσταλλικού πλέγματος Cu
Μέταλλα όπως ο Cu, o Zn, o Ag, o Pt, o Au κ.ά. χρησιμοποιούνται ως ηλεκτρόδια στα διάφορα ηλεκτροχημικά συστήματα για σημαντικές ηλεκτροχημικές εφαρμογές.
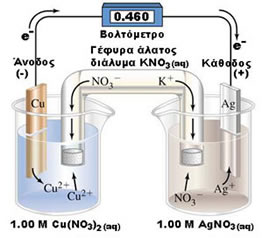
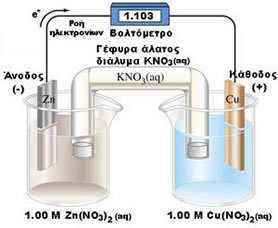
Γαλβανικά στοιχεία με ηλεκτρόδια Cu/Ag και Zn/Cu
Ο τύπος της κρυσταλλικής μεταλλικής δομής επηρεάζει και τις μηχανικές ιδιότητες των μετάλλων. Έτσι για παράδειγμα τα μέταλλα με ενδοκεντρωμένο κυβικό πλέγμα, όπως ο σίδηρος, έχουν μεγάλη μηχανική αντοχή. Τα μέταλλα με εξαγωνικό πλέγμα, όπως το μαγνήσιο και ο ψευδάργυρος, δε σφυρηλατούνται καλά. Το κυβικό μεταλλικό πλέγμα του χρυσού και του χαλκού, τα κάνει περισσότερο όλκιμα.
Ο μεταλλικός δεσμός προσδίδει στα μέταλλα ορισμένες χαρακτηριστικές ιδιότητες που ονομάζεται μεταλλικός χαρακτήρας:
-
Τα μέταλλα έχουν μεταλλική λάμψη και γενικά είναι σκληρά. Όταν φως, (φωτόνια) ορισμένης συχνότητας, πέσει πάνω στην επιφάνεια ενός μετάλλου, τότε τα «επιφανειακά» ηλεκτρόνια που συγκρατούνται χαλαρά, απορροφούν την ενέργεια των φωτονίων αποκτώντας έτσι μεγαλύτερη ενέργεια. Τα ηλεκτρόνια αυτά στη συνέχεια, χάνουν την παραπάνω ενέργεια που πήραν από τα φωτόνια, γεγονός που γίνεται με την εκπομπή φωτεινής ακτινοβολίας. Το εκπεμπόμενο φως είναι που κάνει τα μέταλλα να έχουν την χαρακτηριστική μεταλλική λάμψη.

Μεταλλική λάμψη του πλέγματος του Cu
-
Τα μέταλλα είναι ελατά (δηλαδή μετατρέπονται σε λεπτά μεταλλικά φύλλα τα λεγόμενα ελάσματα) και όλκιμα (δηλαδή μετατρέπονται σε λεπτά σύρματα).
-
Τα μέταλλα είναι θερμικά και ηλεκτρικά αγώγιμα. Τα ελεύθερα ηλεκτρόνια αποτελούν άριστο μέσο μετάδοσης του ηλεκτρισμού επειδή μετακινούνται εύκολα. Στην πραγματικότητα κίνηση ηλεκτρονίων σημαίνει ηλεκτρικό ρεύμα. Επίσης η θερμότητα μεταδίδεται εύκολα. Επειδή αύξηση της θερμοκρασίας σημαίνει αύξηση της κινητικής ενέργειας των ηλεκτρονίων, τα ηλεκτρόνια που βρίσκονται στην άκρη ενός μεταλλικού ελάσματος μπορούν να μεταδίδουν εύκολα την κινητική τους ενέργεια στα γειτονικά ελεύθερα ηλεκτρόνια. Αυξημένη κινητική ενέργεια σημαίνει υψηλότερη θερμοκρασία.


Ελάσματα Cu και σύρματα Mg
|