

- ΟΞΕΙΔΟΑΝΑΓΩΓΗ
- Εισαγωγή
- Αριθμός οξείδωσης
- Οξείδωση-Αναγωγή
- Οξειδωτικά-Αναγωγικά
- Ημιαντιδράσεις οξείδωσης-αναγωγής
- Αντιδράσεις οξειδοαναγωγής με τη μέθοδο ημιαντιδράσεων
- ΙΔΙΟΤΗΤΕΣ ΜΕΤΑΛΛΩΝ-ΑΓΩΓΟΙ
- Εισαγωγή
- Δομή μεταλλικού πλέγματος
- Δραστικότητα μετάλλων
- Ηλεκτροδιαλυτική τάση μετάλλων
- Ηλεκτρικοί αγωγοί
- ΓΑΛΒΑΝΙΚΑ ΣΤΟΙΧΕΙΑ
- Εισαγωγή
- Γαλβανικά στοιχεία
- Ημιστοιχεία-Ε ημιστοιχείων
- Ε0 ημιστοιχείων
- Γέφυρα άλατος
- Συμβολισμός ημιστοιχείου-Ηλεκτρόδια ημιστοιχείων
- Συμβολισμός γαλβανικού στοιχείου
- Ε στοιχείου - Ε0 στοιχείου-Υπολογισμοί Ε0
- Γραφή συνολικής αντίδρασης στοιχείου
- Παραδείγματα γραφής στοιχείων
- ΔG οξειδοαναγωγικής αντίδρασης
- Εξίσωση Nerst
- Παραδείγματα χρήσης εξίσωσης Nerst
- Εφαρμογές στοιχείων -Μπαταρίες
- ΠΕΙΡΑΜΑ - Στοιχείο Daniell
- ΗΛΕΚΤΡΟΛΥΣΗ
- Ηλεκτρολυτικά στοιχεία
- Προϊόντα ηλεκτρόλυσης
- Σύγκριση γαλβανικού – ηλεκτρολυτικού στοιχείου
- Παραδείγματα ηλεκτρόλυσης
- Νόμοι Faraday
- ΠΕΙΡΑΜΑ - Ηλεκτρόλυση Η2Ο ή αρ.δ. H2SO4
2.4 Ηλεκτροδιαλυτική τάση μετάλλων
Όταν προσθέσουμε μικρή ποσότητα νατρίου Na(s) σε καθαρό νερό, συμβαίνει μια αυθόρμητη και ζωηρή αντίδραση που παριστάνεται από τη χημική εξίσωση:
Νa(s) + Η2Ο(l) → ΝaOH (aq) + 1/2H2
Το ΝaOH (aq) βρίσκεται μέσα στο διάλυμα ουσιαστικά με τη μορφή ιόντων Na+(aq) + OH-(aq).
Η αντίδραση αυτή μας δείχνει ότι ορισμένα μέταλλα, όταν προστίθενται στο νερό, παρουσιάζουν μια τάση για διάλυση με ταυτόχρονο σχηματισμό των ιόντων τους.
Το ίδιο φαινόμενο παρατηρείται και όταν έλασμα ενός μετάλλου βυθιστεί σε αραιό υδατικό διάλυμα που περιέχει ιόντα του.
Αυτή η τάση διάλυσης βέβαια δεν είναι ίδια για όλα τα μέταλλα. Για παράδειγμα ο Zn(s), εμφανίζει μια μικρότερη τάσης διάλυσης προς σχηματισμό ιόντων του απ’ ότι το Na, αλλά μεγαλύτερη απ’ ότι ο Cu(s)
Άρα η ηλεκτροδιαλυτική τάση των μετάλλων είναι τόσο μεγαλύτερη όσο πιο ηλεκτροθετικό είναι το μέταλλο δηλαδή όσο πιο μπροστά βρίσκεται στην ηλεκτροχημική σειρά των μετάλλων.
Όταν λοιπόν βυθίσουμε έλασμα Zn(s) σε αραιό υδατικό διάλυμα ιόντων του, όπως για παράδειγμα, σε διάλυμα θειικού ψευδαργύρου Zn2SO4(aq), παρατηρείται το εξής: άτομα της επιφάνειας του μεταλλικού ελάσματος, εγκαταλείποντας πάνω σ’ αυτό τα ηλεκτρόνια της εξωτερικής τους στιβάδας, περνούν στην υδάτινη φάση με τη μορφή ιόντων Zn2+(aq).
Αυτό απεικονίζεται στην ημιαντίδραση: Zn(s) → Zn2+(aq) + 2e-
Το αποτέλεσμα αυτής της συμπεριφοράς είναι να φορτίζεται το μεταλλικό έλασμα αρνητικά και το διάλυμα θετικά. Το φαινόμενο όμως αυτό δεν συμβαίνει μόνο προς μία κατεύθυνση αλλά και αντίστροφα πράγμα που εξαρτάται από τη συγκέντρωση των ιόντων του μετάλλου στο υδατικό διάλυμα. Όταν λοιπόν η συγκέντρωση του διαλύματος είναι μεγάλη, η εκπομπή ιόντων από το μεταλλικό έλασμα προς το διάλυμα παρεμποδίζεται. Μάλιστα, είναι δυνατόν, αντί της εκπομπής, να συμβεί απόθεση ιόντων του μετάλλου, που προέρχονται από το διάλυμα, πάνω στο μεταλλικό έλασμα. Στην περίπτωση αυτή το έλασμα φορτίζεται θετικά και το διάλυμα αρνητικά.
Ουσιαστικά το φαινόμενο είναι αμφίδρομο Zn(s) ![]() Zn2+(aq) + 2e-
Zn2+(aq) + 2e-
Προς ποια κατεύθυνση θα είναι μετατοπισμένη η αντίδραση εξαρτάται από τη συγκέντρωση των ιόντων του μετάλλου στο διάλυμα. Όταν αυτή η συγκέντρωση είναι μεγάλη, η αντίδραση είναι μετατοπισμένη προς τα αριστερά, δηλαδή συμβαίνει απόθεση ιόντων από το διάλυμα στο έλασμα. Όταν αυτή η συγκέντρωση είναι μικρή, τότε η αντίδραση είναι μετατοπισμένη προς τα δεξιά, δηλαδή συμβαίνει απελευθέρωση ιόντων του μετάλλου από το έλασμα προς το διάλυμα.
Άρα όσο μεγαλύτερη είναι η συγκέντρωση του διαλύματος μέσα στο οποίο βρίσκεται βυθισμένο το μεταλλικό έλασμα, τόσο μικρότερη είναι η ηλεκτροδιαλυτική τάση του μετάλλου.
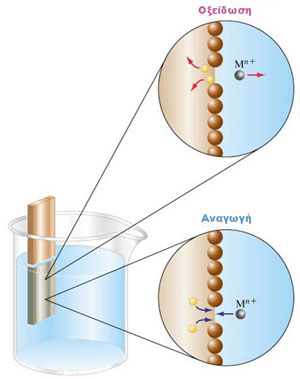
Φαινόμενα οξείδωσης και αναγωγής που συμβαίνουν στο σύστημα
" μεταλλικό έλασμα-υδατικό διάλυμα ιόντων του."
Υπάρχει βέβαια μια χαρακτηριστική τιμή συγκέντρωσης του διαλύματος, στην οποία ούτε απόθεση ιόντων πάνω στο έλασμα συμβαίνει, ούτε και εκπομπή ιόντων από το έλασμα προς το διάλυμα. Στην πραγματικότητα αυτό που συμβαίνει είναι ένα είδος ισορροπίας που παριστάνεται από τη χημική εξίσωση: M(s) ![]() M2+(aq) + 2e-.
M2+(aq) + 2e-.
Δηλαδή στην ισορροπία αυτή όσα ιόντα εκπέμπονται στη μονάδα του χρόνου από το μεταλλικό έλασμα προς το διάλυμα, άλλα τόσα αποτίθενται στη μονάδα του χρόνου από το διάλυμα προς το έλασμα.
Ωστόσο σ’ αυτή τη θέση ισορροπίας υπάρχει μια διαφορά φόρτισης ελάσματος - διαλύματος που εξαρτάται από το είδος του μετάλλου.
Λόγω της διαφοράς αυτής των φορτίων, εμφανίζεται μια διαφορά δυναμικού στο σύστημα μετάλλου-διαλύματος που ονομάζεται δυναμικό του συστήματος μετάλλου-διαλύματος (όπως θα δούμε παρακάτω αυτό εκφράζεται ως δυναμικό ημιστοιχείου ή δυναμικό ηλεκτροδίου)
Συμπερασματικά:
Η τάση διάλυσης ενός μετάλλου, όταν έλασμά του βυθίζεται στο νερό ή σε αραιό διάλυμα, που περιέχει ιόντα του, ονομάζεται ηλεκτροδιαλυτική τάση που παριστάνεται από τη χημική εξίσωση: M(s) ![]() M2+(aq) + 2e-
M2+(aq) + 2e-
Η ηλεκτροδιαλυτική τάση ενός μετάλλου εξαρτάται:
1)Από τη θέση του μετάλλου στην ηλεκτροχημική σειρά των μετάλλων, δηλαδή, η ηλεκτροδιαλυτική τάση των μετάλλων είναι τόσο μεγαλύτερη όσο πιο ηλεκτροθετικό είναι το μέταλλο δηλαδή όσο πιο μπροστά βρίσκεται στην ηλεκτροχημική σειρά των μετάλλων.
2)Από τη συγκέντρωση των ιόντων του μετάλλου στο διάλυμα δηλαδή, όσο μεγαλύτερη είναι η συγκέντρωση του διαλύματος μέσα στο οποίο βρίσκεται βυθισμένο το μεταλλικό έλασμα, τόσο μικρότερη είναι η ηλεκτροδιαλυτική τάση του μετάλλου.
3)Από τη θερμοκρασία
|