

- ΟΞΕΙΔΟΑΝΑΓΩΓΗ
- Εισαγωγή
- Αριθμός οξείδωσης
- Οξείδωση-Αναγωγή
- Οξειδωτικά-Αναγωγικά
- Ημιαντιδράσεις οξείδωσης-αναγωγής
- Αντιδράσεις οξειδοαναγωγής με τη μέθοδο ημιαντιδράσεων
- ΙΔΙΟΤΗΤΕΣ ΜΕΤΑΛΛΩΝ-ΑΓΩΓΟΙ
- Εισαγωγή
- Δομή μεταλλικού πλέγματος
- Δραστικότητα μετάλλων
- Ηλεκτροδιαλυτική τάση μετάλλων
- Ηλεκτρικοί αγωγοί
- ΓΑΛΒΑΝΙΚΑ ΣΤΟΙΧΕΙΑ
- Εισαγωγή
- Γαλβανικά στοιχεία
- Ημιστοιχεία-Ε ημιστοιχείων
- Ε0 ημιστοιχείων
- Γέφυρα άλατος
- Συμβολισμός ημιστοιχείου-Ηλεκτρόδια ημιστοιχείων
- Συμβολισμός γαλβανικού στοιχείου
- Ε στοιχείου - Ε0 στοιχείου-Υπολογισμοί Ε0
- Γραφή συνολικής αντίδρασης στοιχείου
- Παραδείγματα γραφής στοιχείων
- ΔG οξειδοαναγωγικής αντίδρασης
- Εξίσωση Nerst
- Παραδείγματα χρήσης εξίσωσης Nerst
- Εφαρμογές στοιχείων -Μπαταρίες
- ΠΕΙΡΑΜΑ - Στοιχείο Daniell
- ΗΛΕΚΤΡΟΛΥΣΗ
- Ηλεκτρολυτικά στοιχεία
- Προϊόντα ηλεκτρόλυσης
- Σύγκριση γαλβανικού – ηλεκτρολυτικού στοιχείου
- Παραδείγματα ηλεκτρόλυσης
- Νόμοι Faraday
- ΠΕΙΡΑΜΑ - Ηλεκτρόλυση Η2Ο ή αρ.δ. H2SO4
3.2 Γαλβανικά στοιχεία
Τα γαλβανικά στοιχεία είναι πειραματικές διατάξεις όπου παράγεται ηλεκτρικό ρεύμα με τη βοήθεια μιας αυθόρμητης οξειδοαναγωγικής αντίδρασης. Έχουμε δηλαδή μετατροπή της χημικής ενέργειας σε ηλεκτρική.
Τα στοιχεία αυτά αποτελούνται από δύο ηλεκτρόδια ή ημιστοιχεία που συνδέονται μεταξύ τους μέσω ηλεκτρολυτικού συνδέσμου (γέφυρα άλατος), που επιτρέπει τη μετακίνηση των ιόντων των διαλυμάτων, χωρίς όμως να επιτρέπει την ανάμιξη αυτών.
Το ημιστοιχείο στο οποίο πραγματοποιείται η ημιαντίδραση της οξείδωσης αποτελεί τον αρνητικό πόλο του γαλβανικού στοιχείου και ονομάζεται άνοδος, ενώ το ημιστοιχείο στο οποίο πραγματοποιείται η ημιαντίδραση της αναγωγής αποτελεί το θετικό πόλο του γαλβανικού στοιχείου και ονομάζεται κάθοδος.
Αν ο θετικός και ο αρνητικός πόλος συνδεθούν με ένα εξωτερικό ηλεκτρικό κύκλωμα, το συνολικό κύκλωμα διαρρέεται από ηλεκτρικό ρεύμα.
Ένα χαρακτηριστικό παράδειγμα τέτοιας διάταξης είναι το στοιχείο Daniell. Όπως φαίνεται στο παρακάτω σχήμα η άνοδος είναι μια ράβδος Zn βυθισμένη σε διάλυμα ιόντων Zn2+ (διάλυμα νιτρικού ψευδαργύρου Zn(NO3)2) και αποτελεί το αρνητικό ηλεκτρόδιο (ημιστοιχείο ανόδου), όπου συμβαίνει διαδικασία οξείδωσης σύμφωνα με την αντίδραση:
Άνοδος (-) Zn(s) ![]() Zn2+(aq) + 2e-
Zn2+(aq) + 2e-
Οξείδωση
Εδώ γεννιούνται τα ηλεκτρόνια τα οποία μετακινούνται μέσω του εξωτερικού κυκλώματος προς την κάθοδο.
H κάθοδος είναι μια ράβδος Cu βυθισμένη σε διάλυμα ιόντων Cu2+ (διάλυμα Cu(NO3)2) και αποτελεί το θετικό ηλεκτρόδιο (ημιστοιχείο καθόδου), όπου συμβαίνει διαδικασία αναγωγής σύμφωνα με την αντίδραση:
Κάθοδος (+) Cu2+(aq) + 2e- ![]() Cu(s)
Cu(s)
Αναγωγή
Η συνολική οξειδοαναγωγική αντίδραση που συμβαίνει προκύπτει από το άθροισμα των δύο ημιαντιδράσεων:
Άνοδος (-) Zn(s) ![]() Zn2+(aq) + 2e-
Zn2+(aq) + 2e-
Οξείδωση
Κάθοδος (+) Cu2+(aq) + 2e- ![]() Cu(s)
Cu(s)
Αναγωγή
---------------------------------------------------
Συνολική αντίδραση Zn(s) + Cu2+(aq) ![]() Zn2+(aq) + Cu(s)
Zn2+(aq) + Cu(s)
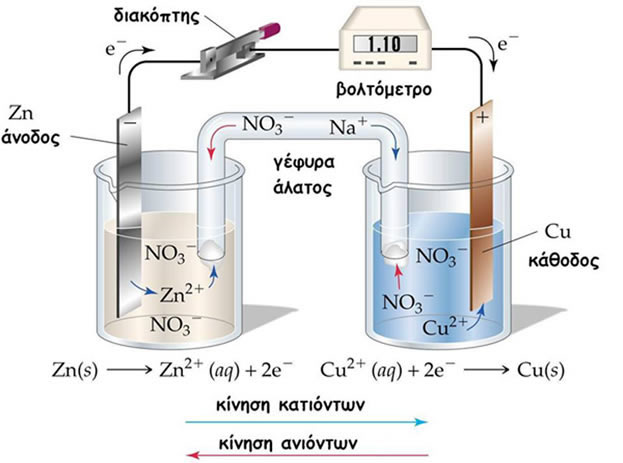
Γαλβανικό στοιχείο Daniell
Στο εξωτερικό κύκλωμα μπορούμε να παρεμβάλουμε ένα βολτόμετρο για τη μέτρηση της τάσης του ρεύματος που παράγεται.
|