

- ΟΞΕΙΔΟΑΝΑΓΩΓΗ
- Εισαγωγή
- Αριθμός οξείδωσης
- Οξείδωση-Αναγωγή
- Οξειδωτικά-Αναγωγικά
- Ημιαντιδράσεις οξείδωσης-αναγωγής
- Αντιδράσεις οξειδοαναγωγής με τη μέθοδο ημιαντιδράσεων
- ΙΔΙΟΤΗΤΕΣ ΜΕΤΑΛΛΩΝ-ΑΓΩΓΟΙ
- Εισαγωγή
- Δομή μεταλλικού πλέγματος
- Δραστικότητα μετάλλων
- Ηλεκτροδιαλυτική τάση μετάλλων
- Ηλεκτρικοί αγωγοί
- ΓΑΛΒΑΝΙΚΑ ΣΤΟΙΧΕΙΑ
- Εισαγωγή
- Γαλβανικά στοιχεία
- Ημιστοιχεία-Ε ημιστοιχείων
- Ε0 ημιστοιχείων
- Γέφυρα άλατος
- Συμβολισμός ημιστοιχείου-Ηλεκτρόδια ημιστοιχείων
- Συμβολισμός γαλβανικού στοιχείου
- Ε στοιχείου - Ε0 στοιχείου-Υπολογισμοί Ε0
- Γραφή συνολικής αντίδρασης στοιχείου
- Παραδείγματα γραφής στοιχείων
- ΔG οξειδοαναγωγικής αντίδρασης
- Εξίσωση Nerst
- Παραδείγματα χρήσης εξίσωσης Nerst
- Εφαρμογές στοιχείων -Μπαταρίες
- ΠΕΙΡΑΜΑ - Στοιχείο Daniell
- ΗΛΕΚΤΡΟΛΥΣΗ
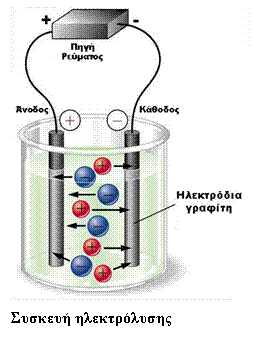
- Ηλεκτρολυτικά στοιχεία
- Προϊόντα ηλεκτρόλυσης
- Σύγκριση γαλβανικού – ηλεκτρολυτικού στοιχείου
- Παραδείγματα ηλεκτρόλυσης
- Νόμοι Faraday
- ΠΕΙΡΑΜΑ - Ηλεκτρόλυση Η2Ο ή αρ.δ. H2SO4
ΠΕΙΡΑΜΑ
Ηλεκτρόλυση νερού ή ηλεκτρόλυση αραιού διαλύματος θειικού οξέος με ηλεκτρόδια λευκοχρύσου (Pt).
Διδακτική εφαρμογή: Το πείραμα της ηλεκτρόλυσης του νερού βασίζεται στη θεωρία της Χημείας Κατεύθυνσης Β΄ Λυκείου και απευθύνεται τόσο σε μαθητές όσο και σε φοιτητές.
Σκοπός πειράματος: Να δείξουμε τη διαδικασία της ηλεκτρόλυσης και τη διάσπαση του νερού με αυτήν.
Στόχοι πειράματος: Στο τέλος αυτού του πειράματος θα πρέπει ο μαθητής – φοιτητής:
- Να έχει εξοικειωθεί με τη διαδικασία της ηλεκτρόλυσης.
- Να μπορεί να αναγνωρίζει την οξειδοαναγωγική δράση που «κρύβει» μια ηλεκτρολυτική διεργασία.
- Να μπορεί να παρασκευάζει στοιχεία (Ο2,Η2) χρησιμοποιώντας τη διαδικασία της ηλεκτρόλυσης.
- Να έχει κατανοήσει το μηχανισμό της ηλεκτρόλυσης και τη σημασία της διέλευσης ηλεκτρικού ρεύματος μέσα από διάλυμα ηλεκτρολύτη (διάλυμα H2SO4).
- Να έχει αποκτήσει κάποια εξοικείωση με τη χρήση εργαστηριακών οργάνων Χημείας.
- Να μπορεί να εξηγεί τις αλλαγές που παρατηρούνται κατά τη διάρκεια μιας ηλεκτροχημικής αντίδρασης (σχηματισμός αερίων Η2, Ο2).
- Να μπορεί να κάνει ταυτοποίηση των προϊόντων της ηλεκτρόλυσης.
Σκεύη – Συσκευές – Υλικά:
1) Συσκευή ηλεκτρόλυσης Hoffman με ηλεκτρόδια Pt
2) Μετασχηματιστής ή μπαταρίες 16V (4X4,5V).
3) Χωνί διήθησης
4) Αναπτήρας με μακρύ λαιμό
5) 2 καλώδια σύνδεσης με κροκοδειλάκια
6) 1 μικρός δοκιμαστικός σωλήνας
7) Παρασχίδα ανίχνευσης οξυγόνου (Ο2)
8) Μονωτική ταινία για στερέωση των ηλεκτροδίων
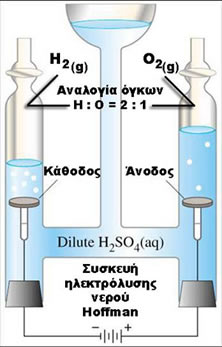
Συσκευή Hoffman
Αντιδραστήρια:
Διάλυμα θειικού οξέος (H2SO4) 25% w/w
Πειραματική διαδικασία:
1) Τοποθετούμε τα δύο ηλεκτρόδια της συσκευής Hoffman. Επειδή υπάρχει κίνδυνος να αποσυνδεθούν, λόγω της πίεσης που ασκεί το διάλυμα του θειικού οξέος, τα στερεώνουμε στη γυάλινη συσκευή Hoffman με τη βοήθεια μονωτικής ταινίας.
2) Με το διάλυμα του θειικού οξέος (H2SO4) 25% w/w, γεμίζουμε το βολτάμετρο τύπου Hoffman ως εξής:
- Ανοίγουμε τη μία στρόφιγγα και προσθέτουμε το διάλυμα του οξέος από το μεσαίο σωλήνα.
- Το διάλυμα πρέπει να φτάσει μέχρι τη βάση της στρόφιγγας και όχι μέσα σ’ αυτήν.
- Κλείνουμε τη στρόφιγγα αυτή και ανοίγουμε την άλλη ώστε να γεμίσει και ο άλλος σωλήνας με τον ίδιο ακριβώς τρόπο.
- Συμπληρώνουμε το μεσαίο σωλήνα με το διάλυμα του οξέος μέχρι το σημείο που αρχίζει να διευρύνεται.
3) Συνδέουμε τα ηλεκτρόδια της συσκευής, με τη βοήθεια των καλωδίων που φέρουν κροκοδειλάκια, με τους πόλους του μετασχηματιστή, με τάση περίπου 16V ή με 4 μπαταρίες των 4,5 V συνδεμένες σε σειρά.
4) Μετά τη διέλευση 10-15 λεπτών καταγράφουμε τις παρατηρήσεις μας.

Διαδικασία ανίχνευσης αερίων προϊόντων της ηλεκτρόλυσης:
1) Μετά τη διέλευση 10-15 λεπτών παρατηρούμε αλλαγή της στάθμης του διαλύματος του οξέος στους δύο σωλήνες της συσκευής, εξ’ αιτίας της παραγωγής αερίων (Η2, Ο2), με τη μορφή φυσαλίδων, με αναλογία όγκων 2:1 αντίστοιχα.

2) Για την ανίχνευση του Ο2 που παράγεται στην άνοδο (+) κάνουμε το εξής: Πλησιάζουμε στο στόμιο του σωλήνα, που περιέχει το αέριο Ο2 (το τμήμα της συσκευής με τη μικρότερη ποσότητα αερίου), μια μισοσβησμένη παρασχίδα και ανοίγουμε σιγά-σιγά τη στρόφιγγα, οπότε και παρατηρούμε ανάφλεξη της παρασχίδας.

3) Για την ανίχνευση του Η2 που παράγεται στην κάθοδο (-) κάνουμε το εξής: Πλησιάζουμε το στόμιο δοκιμαστικού σωλήνα στο σημείο της στρόφιγγας που αντιστοιχεί στο σωλήνα που περιέχει το αέριο Η2 (το τμήμα της συσκευής με τη μεγαλύτερη ποσότητα αερίου). Στη συνέχεια ανοίγουμε τη στρόφιγγα ώστε το αέριο να μπει μέσα στο δοκιμαστικό σωλήνα και πολύ γρήγορα, (ώστε να μην προλάβει να διαφύγει το αέριο), πλησιάζουμε στο στόμιο του σωλήνα αναμμένο μακρόλαιμο αναπτήρα οπότε και ακούγεται ένας χαρακτηριστικός κρότος εξ’ αιτίας του υδρογόνου: 2Η2(g) + O2(g) → 2H2O(l). Ο κρότος ακούγεται επειδή γίνεται απότομα, με την ανάφλεξη, ελάττωση του όγκου των αερίων, δηλαδή οι τρεις όγκοι (δύο όγκοι Η2(g) και ένας όγκος O2(g), γίνονται δύο όγκοι H2O(l)).

Η Χημεία του πειράματος:
Στο διάλυμα γίνονται οι εξής αντιδράσεις:
α) Αντιδράσεις ιοντισμού του διαλύματος του H2SO4:
H2SO4(aq) → H+(aq) + HSO4-(aq)
HSO4-(aq) ![]() H+(aq) + SO42-(aq)
H+(aq) + SO42-(aq)
β) Αντίδραση ιοντισμού του νερού:
H2O(l) ![]() H+(aq) + OH-(aq)
H+(aq) + OH-(aq)
Επομένως στο διάλυμα εμφανίζονται τα εξής :
SO42-, HSO4- : Λόγω ιοντισμού του θειικού οξέος
H+ : Λόγω ιοντισμού του θειικού οξέος και του νερού
OH- : Λόγω ιοντισμού του νερού
Η2Ο : Υπάρχουν και μόρια νερού που δεν έχουν ιοντιστεί
Κάθοδος (-) : Προς την κάθοδο θα κινηθούν τα H+, H2O. Το περιβάλλον στην περιοχή της καθόδου είναι όξινο (αφού τα Η+ προέρχονται κυρίως από τον ιοντισμό του H2SO4). Μεταξύ αυτών των δύο από τη σειρά εκφόρτισης προηγούνται τα Η+. Άρα αυτά θα αναχθούν στην κάθοδο σύμφωνα με την αντίδραση:
Κάθοδος: 2Η+(aq) + 2e- ![]() Η2(g)
Η2(g)
Άνοδος (+) : Προς την άνοδο θα κινηθούν τα HSO4- , SO42-, OH-, H2O. Στην περιοχή αυτή υπάρχουν πολύ λίγα ΟΗ- (αφού αυτά προέρχονται από τον ιοντισμό του Η2Ο) δηλαδή το περιβάλλον στην περιοχή της ανόδου δεν είναι βασικό. Άρα ουσιαστικά συναγωνίζονται τα HSO4- , SO42- και τα H2O. Μεταξύ αυτών από τη σειρά εκφόρτισης προηγούνται τα Η2Ο. Άρα αυτά θα οξειδωθούν στην άνοδο σύμφωνα με την αντίδραση (οξείδωση του οξυγόνου του Η2Ο) :
Άνοδος: Η2Ο(l) ![]() 2Η+(aq) + ½Ο2(g) + 2e-
2Η+(aq) + ½Ο2(g) + 2e-
Προσθέτοντας τις δύο αντιδράσεις διαπιστώνουμε ότι το συνολικό αποτέλεσμα της ηλεκτρόλυσης του θειικού οξέος ανταποκρίνεται στον ιοντισμό του νερού, για το λόγο αυτό πιο συχνά, η ηλεκτρόλυση του θειικού οξέος ονομάζεται «ηλεκτρόλυση νερού».
Κάθοδος (-) : 2Η+(aq) + 2e- ![]() Η2(g)
Η2(g)
Άνοδος (+) : Η2Ο(l) ![]() 2Η+(aq) + ½Ο2(g) + 2e-
2Η+(aq) + ½Ο2(g) + 2e-
Συνολική αντίδραση: Η2Ο(l) ![]() Η2(g) + ½Ο2(g) ή 2Η2Ο(l)
Η2(g) + ½Ο2(g) ή 2Η2Ο(l) ![]() 2Η2(g) + Ο2(g)
2Η2(g) + Ο2(g)
Εργαστηριακή αναφορά |
|
Επώνυμο: |
|
Όνομα: |
|
Τμήμα: |
|
Ημερομηνία: |
|
Προεργαστηριακές ερωτήσεις:
1. Να απαντήσετε τι ισχύει σε ένα ηλεκτρολυτικό στοιχείο:
α) Σε ποιο ηλεκτρόδιο γίνεται οξείδωση και σε ποιο αναγωγή;
β) Ποιο είναι το θετικό και ποιο το αρνητικό ηλεκτρόδιο;
γ) Ποιο ηλεκτρόδιο συνδέεται με τον αρνητικό και ποιο με το θετικό πόλο της πηγής;
2. Να απαντήσετε στις εξής ερωτήσεις:
α) Τι ονομάζεται ηλεκτρόλυση;
β) Ποια είναι η ροή των ηλεκτρονίων κατά τη λειτουργία μιας ηλεκτρολυτικής συσκευής;
3. Να δοθεί σχηματικά η ηλεκτρόλυση υδατικού διαλύματος ΚΟΗ, (ημιαντιδράσεις οξείδωσης – αναγωγής και προϊόντα ημιαντιδράσεων – σχήμα ηλεκτρολυτικού στοιχείου), με ηλεκτρόδια Pt. Να συμβουλευτείτε την παρακάτω σειρά εκφόρτισης ανιόντων και κατιόντων:
Η σειρά εκφόρτισης κατιόντων στην κάθοδο (-)είναι:
Au3+ > Pt2+ > Ag+ > Cu2+ >H+(οξύ)> Pb2+ > Sn2+ > Ni2+ > [H2O] > Fe2+ > Cr3+ > Zn2+ > Mn2+ > Al3+ > Mg2+ > Na+ > Ca2+ > Ba2+ > K+
Η σειρά εκφόρτισης ανιόντων στην άνοδο (+) είναι:
S2- > OH- (βάση) > J- > [H2O] > Br- > Cl- > οξυγονούχα ιόντα > F-
Μεταεργαστηριακές ερωτήσεις:
1. Αν παρατηρήσουμε τη συσκευή λίγη ώρα μετά την έναρξη της ηλεκτρόλυσης, θα διαπιστώσουμε ότι ο όγκος του αερίου που έχει παραχθεί στον ένα σωλήνα είναι διπλάσιος από τον όγκο του αερίου που έχει παραχθεί στον άλλο. Τι συμπέρασμα βγάζουμε απ’ αυτό για τη σύσταση του νερού; Τι σχέση θα είχαν οι όγκοι, αν κάναμε ηλεκτρόλυση πυκνού διαλύματος υδροχλωρικού οξέος;
2. Γιατί χρησιμοποιούμε ηλεκτρόδια λευκοχρύσου (Pt) και άνθρακα (C) και όχι ηλεκτρόδια από άλλο μέταλλο;
3. Γιατί συμπληρώνουμε το μεσαίο σωλήνα με το διάλυμα του οξέος μέχρι το σημείο που αρχίζει να διευρύνεται και όχι περισσότερο;
4. Πώς δικαιολογείται ο χαρακτηριστικός κρότος που ακούμε όταν πλησιάσουμε με αναμμένο αναπτήρα το στόμιο του δοκιμαστικού σωλήνα όπου έχει συλλεγεί το αέριο υδρογόνο;
Απαντήσεις στις προεργαστηριακές ερωτήσεις:
1. α) Κατά τη λειτουργία ενός ηλεκτρολυτικού στοιχείου, οξείδωση πραγματοποιείται στο ηλεκτρόδιο της ανόδου και αναγωγή πραγματοποιείται στο ηλεκτρόδιο της καθόδου.
β) Θετικό είναι το ηλεκτρόδιο της ανόδου και αρνητικό είναι το ηλεκτρόδιο της καθόδου.
γ) Με το θετικό πόλο της πηγής συνδέεται το ηλεκτρόδιο της ανόδου και με τον αρνητικό πόλο της πηγής συνδέεται το ηλεκτρόδιο της καθόδου.
2. α) Ηλεκτρόλυση είναι το σύνολο των αντιδράσεων οξείδωσης και αναγωγής που λαμβάνουν χώρα σε ένα τήγμα ή διάλυμα ενός ηλεκτρολύτη όταν εφαρμόσουμε κατάλληλη διαφορά δυναμικού στα άκρα των ηλεκτροδίων.
β) Η ροή των ηλεκτρονίων κατά τη λειτουργία μιας ηλεκτρολυτικής συσκευής είναι η εξής:
- Τα ηλεκτρόνια γεννιούνται στην άνοδο από διαδικασία οξείδωσης.
- Μετακινούνται μέσω μεταλλικού αγωγού στο θετικό πόλο της πηγής όπου προσελκύονται.
- Από τον αρνητικό πόλο της πηγής προωθούνται στην κάθοδο, όπου και καταναλώνονται σε διαδικασία αναγωγής.
3. Στο διάλυμα γίνονται οι εξής αντιδράσεις:
ΚΟΗ(s) → Κ+(aq) + ΟΗ-(aq)
H2O(l) ![]() H+(aq) + OH-(aq)
H+(aq) + OH-(aq)
Άρα μέσα στο διάλυμα του ηλεκτρολύτη υπάρχουν: Κ+, Η+, OH-, H2O
Κάθοδος (-) : Προς την κάθοδο θα κινηθούν τα Κ+, H+, H2O. Το περιβάλλον στην περιοχή αυτή δεν είναι όξινο (αφού τα Η+ προέρχονται κυρίως από τον ιοντισμό του H2Ο). Άρα ουσιαστικά συναγωνίζονται τα Κ+ και τα Η2Ο. Μεταξύ αυτών των δύο από τη σειρά εκφόρτισης προηγούνται τα Η2Ο. Άρα αυτά θα αναχθούν στην κάθοδο σύμφωνα με την αντίδραση (αναγωγή του υδρογόνου του Η2Ο) :
Κάθοδος: 2Η2Ο(l)+ 2e- ![]() Η2(g) + 2ΟΗ-(aq)
Η2(g) + 2ΟΗ-(aq)
Άνοδος (+) : Προς την άνοδο θα κινηθούν τα OH-, H2O. Το περιβάλλον στην περιοχή αυτή είναι βασικό, αφού τα ΟΗ- προέρχονται κυρίως από τον ιοντισμό του ΚΟΗ. Μεταξύ αυτών των δύο από τη σειρά εκφόρτισης προηγούνται τα ΟΗ-. Άρα αυτά θα οξειδωθούν στην άνοδο σύμφωνα με την αντίδραση :
Άνοδος: 2ΟΗ-(aq) ![]() Η2Ο(l) + ½ Ο2(g) + 2e-
Η2Ο(l) + ½ Ο2(g) + 2e-

Ηλεκτρόλυση υδατικού διαλύματος ΚΟΗ με ηλεκτρόδια Pt
Απαντήσεις στις μεταεργαστηριακές ερωτήσεις:
1. Με αυτό τον τρόπο επιβεβαιώνεται ότι η σύσταση του νερού (Η2Ο) είναι 2:1, δηλαδή απαιτούνται δύο άτομα υδρογόνου και ένα άτομο οξυγόνου για το σχηματισμό ενός μορίου νερού.
Εάν κάναμε ηλεκτρόλυση πυκνού διαλύματος HCl τότε θα διαπιστώναμε ότι η αναλογία όγκων υδρογόνου και χλωρίου που παράγονται, είναι 1:1 μια και συμβαίνουν τα εξής κατά την ηλεκτρόλυσή του:
Στο διάλυμα γίνονται οι εξής αντιδράσεις:
HCl(aq) → H+(aq) + Cl-(aq)
H2O(l) ![]() H+(aq) + OH-(aq)
H+(aq) + OH-(aq)
Άρα μέσα στο διάλυμα του ηλεκτρολύτη υπάρχουν: Cl-, , H+, OH-, H2O
Κάθοδος (-) : Προς την κάθοδο θα κινηθούν τα H+, H2O. Το περιβάλλον στην περιοχή της καθόδου είναι όξινο (αφού τα Η+ προέρχονται κυρίως από τον ιοντισμό του HCl). Μεταξύ αυτών των δύο από τη σειρά εκφόρτισης προηγούνται τα Η+. Άρα αυτά θα αναχθούν στην κάθοδο σύμφωνα με την αντίδραση:
Κάθοδος: 2Η+(aq) + 2e- ![]() Η2(g)
Η2(g)
Άνοδος (+) : Προς την άνοδο θα κινηθούν τα Cl-, OH-, H2O. Στην περιοχή της ανόδου υπάρχουν πολύ λίγα ΟΗ- (αφού αυτά προέρχονται από τον ιοντισμό του Η2Ο) δηλαδή το περιβάλλον στην περιοχή αυτή δεν είναι βασικό. Άρα ουσιαστικά συναγωνίζονται τα Cl- και τα H2O. Μεταξύ αυτών των δύο από τη σειρά εκφόρτισης προηγούνται τα Η2Ο. Άρα αυτά θα έπρεπε να οξειδωθούν στην άνοδο. Παρόλα αυτά, στην άνοδο πάνε και οξειδώνονται τα Cl- γιατί έχουν μεγαλύτερη συγκέντρωση. H αντίδραση οξείδωσης των Cl- είναι :
Άνοδος: 2Cl-(aq) ![]() Cl2(g) + 2e-
Cl2(g) + 2e-
2. Αδρανή ηλεκτρόδια θεωρούνται τα ηλεκτρόδια που δεν αντιδρούν με τα συστατικά που ηλεκτρολύονται και απλώς λειτουργούν σαν αγωγοί ρεύματος. Συνήθως σαν αδρανή ηλεκτρόδια χρησιμοποιούνται ηλεκτρόδια από λευκόχρυσο (Pt) ή από γραφίτη (C). Εάν λοιπόν τα ηλεκτρόδιά μας δεν ήταν αδρανή θα είχαμε και δευτερεύουσες αντιδράσεις μεταξύ του υλικού των ηλεκτροδίων και των προϊόντων της ηλεκτρόλυσης ή μεταξύ του υλικού των ηλεκτροδίων και του διαλύματος του ηλεκτρολύτη.
3. Γιατί καθώς γίνεται η διαδικασία της ηλεκτρόλυσης και παράγονται τα αέρια στα δύο σκέλη της ηλεκτρολυτικής συσκευής, το διάλυμα του ηλεκτρολύτη στους δύο σωλήνες πιέζεται από τα αέρια και υποχωρεί προς τα κάτω προκαλώντας άνοδο της στάθμης του στο μεσαίο σωλήνα, γεγονός που θα προκαλούσε υπερχείλιση του υγρού σε αυτόν, εάν τον γεμίζαμε αρχικά μέχρι επάνω.
4. Κατά την ανάφλεξη του υδρογόνου παράγεται «κροτούν αέριο» σύμφωνα με τη χημική εξίσωση: 2Η2(g) + O2(g) → 2H2O(l). Ο κρότος ακούγεται επειδή γίνεται απότομα, με την ανάφλεξη, ελάττωση του όγκου των αερίων, δηλαδή οι τρεις όγκοι (δύο όγκοι Η2(g) και ένας όγκος O2(g), γίνονται δύο όγκοι H2O(l)).
|