

- ΟΞΕΙΔΟΑΝΑΓΩΓΗ
- Εισαγωγή
- Αριθμός οξείδωσης
- Οξείδωση-Αναγωγή
- Οξειδωτικά-Αναγωγικά
- Ημιαντιδράσεις οξείδωσης-αναγωγής
- Αντιδράσεις οξειδοαναγωγής με τη μέθοδο ημιαντιδράσεων
- ΙΔΙΟΤΗΤΕΣ ΜΕΤΑΛΛΩΝ-ΑΓΩΓΟΙ
- Εισαγωγή
- Δομή μεταλλικού πλέγματος
- Δραστικότητα μετάλλων
- Ηλεκτροδιαλυτική τάση μετάλλων
- Ηλεκτρικοί αγωγοί
- ΓΑΛΒΑΝΙΚΑ ΣΤΟΙΧΕΙΑ
- Εισαγωγή
- Γαλβανικά στοιχεία
- Ημιστοιχεία-Ε ημιστοιχείων
- Ε0 ημιστοιχείων
- Γέφυρα άλατος
- Συμβολισμός ημιστοιχείου-Ηλεκτρόδια ημιστοιχείων
- Συμβολισμός γαλβανικού στοιχείου
- Ε στοιχείου - Ε0 στοιχείου-Υπολογισμοί Ε0
- Γραφή συνολικής αντίδρασης στοιχείου
- Παραδείγματα γραφής στοιχείων
- ΔG οξειδοαναγωγικής αντίδρασης
- Εξίσωση Nerst
- Παραδείγματα χρήσης εξίσωσης Nerst
- Εφαρμογές στοιχείων -Μπαταρίες
- ΠΕΙΡΑΜΑ - Στοιχείο Daniell
- ΗΛΕΚΤΡΟΛΥΣΗ
- Ηλεκτρολυτικά στοιχεία
- Προϊόντα ηλεκτρόλυσης
- Σύγκριση γαλβανικού – ηλεκτρολυτικού στοιχείου
- Παραδείγματα ηλεκτρόλυσης
- Νόμοι Faraday
- ΠΕΙΡΑΜΑ - Ηλεκτρόλυση Η2Ο ή αρ.δ. H2SO4
4.1 Ηλεκτρολυτικά στοιχεία ή βολτάμετρα
Ηλεκτρόλυση είναι το σύνολο των αντιδράσεων οξείδωσης και αναγωγής που λαμβάνουν χώρα σε ένα τήγμα ή διάλυμα ενός ηλεκτρολύτη όταν εφαρμόσουμε κατάλληλη διαφορά δυναμικού στα άκρα των ηλεκτροδίων.
- Η συσκευή της ηλεκτρόλυσης ονομάζεται ηλεκτρολυτικό στοιχείο ή βολτάμετρο και περιλαμβάνει το δοχείο, τα ηλεκτρόδια, τον ηλεκτρολύτη και την πηγή ρεύματος.
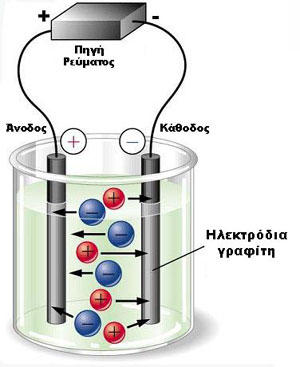
Συσκευή ηλεκτρόλυσης
- Κατά την ηλεκτρόλυση πραγματοποιείται μετατροπή της ηλεκτρικής ενέργειας σε χημική ενέργεια.
- Μέσα στον ηλεκτρολυτικό αγωγό (ηλεκτρολύτης), τήγμα ή διάλυμα, δεν έχουμε μετακίνηση ηλεκτρονίων αλλά ιόντων του ηλεκτρολύτη.
- Τα ηλεκτρόνια μετακινούνται στο εξωτερικό κύκλωμα που συνδέει την πηγή ρεύματος (μπαταρία) με τα δύο ηλεκτρόδια.
- Το ηλεκτρόδιο που συνδέεται με το θετικό πόλο (+) της πηγής ονομάζεται άνοδος, ενώ το ηλεκτρόδιο που συνδέεται με τον αρνητικό πόλο της πηγής (-) ονομάζεται κάθοδος.
- Όπως φαίνεται στο παρακάτω σχήμα ηλεκτρόλυσης τήγματος NaCl , η μπαταρία προωθεί ηλεκτρόνια στην κάθοδο, που γι’ αυτό το λόγο είναι το αρνητικό ηλεκτρόδιο, όπου και πραγματοποιείται αναγωγή των θετικά φορτισμένων ιόντων του ηλεκτρολύτη που προσελκύονται στο ηλεκτρόδιο αυτό.
- Στο ηλεκτρόδιο της ανόδου, που είναι το θετικά φορτισμένο ηλεκτρόδιο, προσελκύονται τα ανιόντα του ηλεκτρολύτη και υφίστανται οξείδωση. Τα ηλεκτρόνια που γεννιούνται από την οξείδωση, προσελκύονται από το θετικό πόλο της πηγής, αφήνοντας το ηλεκτρόδιο της ανόδου θετικά φορτισμένο.
- Επομένως η ροή των ηλεκτρονίων είναι η εξής:
- Τα ηλεκτρόνια γεννιούνται στην άνοδο από διαδικασία οξείδωσης.
- Μετακινούνται μέσω μεταλλικού αγωγού στο θετικό πόλο της πηγής όπου προσελκύονται.
- Από τον αρνητικό πόλο της πηγής προωθούνται στην κάθοδο, όπου και καταναλώνονται σε διαδικασία αναγωγής.
- Οι κυριότερες αντιδράσεις που γίνονται κατά τη διάρκεια της ηλεκτρόλυσης είναι οξειδοαναγωγικές αντιδράσεις κατά τις οποίες παράγονται αέρια ή αποτίθενται ή διαλύονται μέταλλα.
- Κατά την ηλεκτρόλυση μπορούν να συμβούν τα εξής:
- Ένα ιόν ή ένα μόριο σε διάλυμα μπορεί να οξειδωθεί ή να αναχθεί στο αντίστοιχο ηλεκτρόδιο.
- Ο ίδιος ο διαλύτης (π.χ. το νερό) μπορεί να οξειδωθεί ή να αναχθεί στο αντίστοιχο ηλεκτρόδιο.
- Το ίδιο το ηλεκτρόδιο μπορεί να οξειδωθεί όταν υπάρχουν ιόντα στο διάλυμα.

Ηλεκτρόλυση τήγματος NaCl
Δύο ερωτήματα προκύπτουν κατά τη μελέτη της ηλεκτρόλυσης:
- Πώς μπορούμε να προβλέψουμε τα προϊόντα της ηλεκτρόλυσης;
- Ποια τάση πρέπει να εφαρμοστεί για να πραγματοποιηθεί μια ηλεκτρόλυση;
|