

- ΟΞΕΙΔΟΑΝΑΓΩΓΗ
- Εισαγωγή
- Αριθμός οξείδωσης
- Οξείδωση-Αναγωγή
- Οξειδωτικά-Αναγωγικά
- Ημιαντιδράσεις οξείδωσης-αναγωγής
- Αντιδράσεις οξειδοαναγωγής με τη μέθοδο ημιαντιδράσεων
- ΙΔΙΟΤΗΤΕΣ ΜΕΤΑΛΛΩΝ-ΑΓΩΓΟΙ
- Εισαγωγή
- Δομή μεταλλικού πλέγματος
- Δραστικότητα μετάλλων
- Ηλεκτροδιαλυτική τάση μετάλλων
- Ηλεκτρικοί αγωγοί
- ΓΑΛΒΑΝΙΚΑ ΣΤΟΙΧΕΙΑ
- Εισαγωγή
- Γαλβανικά στοιχεία
- Ημιστοιχεία-Ε ημιστοιχείων
- Ε0 ημιστοιχείων
- Γέφυρα άλατος
- Συμβολισμός ημιστοιχείου-Ηλεκτρόδια ημιστοιχείων
- Συμβολισμός γαλβανικού στοιχείου
- Ε στοιχείου - Ε0 στοιχείου-Υπολογισμοί Ε0
- Γραφή συνολικής αντίδρασης στοιχείου
- Παραδείγματα γραφής στοιχείων
- ΔG οξειδοαναγωγικής αντίδρασης
- Εξίσωση Nerst
- Παραδείγματα χρήσης εξίσωσης Nerst
- Εφαρμογές στοιχείων -Μπαταρίες
- ΠΕΙΡΑΜΑ - Στοιχείο Daniell
- ΗΛΕΚΤΡΟΛΥΣΗ
- Ηλεκτρολυτικά στοιχεία
- Προϊόντα ηλεκτρόλυσης
- Σύγκριση γαλβανικού – ηλεκτρολυτικού στοιχείου
- Παραδείγματα ηλεκτρόλυσης
- Νόμοι Faraday
- ΠΕΙΡΑΜΑ - Ηλεκτρόλυση Η2Ο ή αρ.δ. H2SO4
ΠΕΙΡΑΜΑ
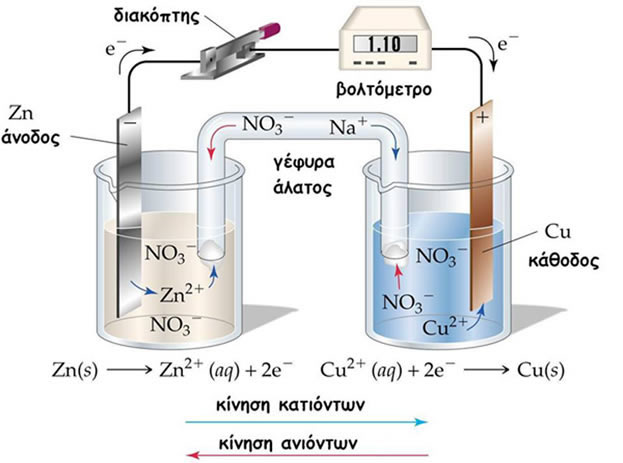
Κατασκευή γαλβανικού στοιχείου Daniell:
Zn(s) / Zn2+(aq) // Cu2+(aq) / Cu(s)
Διδακτική εφαρμογή: Το πείραμα της κατασκευής γαλβανικού στοιχείου Daniell βασίζεται στη θεωρία της Χημείας Κατεύθυνσης Γ΄ Λυκείου και απευθύνεται τόσο σε μαθητές όσο και σε φοιτητές.
Σκοπός πειράματος: Να δείξουμε τη διαδικασία λειτουργίας ενός γαλβανικού στοιχείου και το αποτέλεσμα της λειτουργίας αυτής, δηλαδή την παραγωγή ηλεκτρικού ρεύματος μέσω της μετατροπής της χημικής ενέργειας σε ηλεκτρική.
Στόχοι πειράματος: Στο τέλος αυτού του πειράματος θα πρέπει ο μαθητής – φοιτητής:
- Να έχει εξοικειωθεί με την κατασκευή ενός γαλβανικού στοιχείου.
- Να μπορεί να αναγνωρίζει την οξειδοαναγωγική δράση που «κρύβει» η λειτουργία ενός γαλβανικού στοιχείου.
- Να έχει κατανοήσει τη σημασία των αντιδράσεων οξείδωσης και αναγωγής στη λειτουργία του γαλβανικού στοιχείου και άρα στη μετατροπή της χημικής ενέργειας σε ηλεκτρική.
- Να έχει αποκτήσει κάποια εξοικείωση με τη χρήση εργαστηριακών οργάνων Χημείας.
- Να μπορεί να μετρά το δυναμικό του γαλβανικού στοιχείου.
Σκεύη – Συσκευές – Υλικά:
1) 2 ποτήρια για ηλεκτρόλυση
2)Ελάσματα ψευδαργύρου και χαλκού διαστάσεων 30Χ100 mm (ηλεκτρόδια)
3) Γέφυρα ιόντων: Διηθητικό χαρτί διαστάσεων 10Χ20 cm κατάλληλα διπλωμένο σε ρολό και διαβρεγμένο με διάλυμα NaCl. Εναλλακτικά μπορεί να χρησιμοποιηθεί διάλυμα θειικού καλίου (K2SO4) ή κορεσμένο διάλυμα νιτρικού καλίου (ΚΝΟ3) ή κορεσμένο διάλυμα χλωριούχου καλίου (ΚCl)
4) Μιλλιβολτόμετρο 0-2V
5) 2 καλώδια σύνδεσης με κροκοδειλάκια, γυαλόχαρτο και λεπτό σύρμα
Αντιδραστήρια:
1) Διάλυμα θειικού χαλκού (CuSO4) 1M
2) Διάλυμα θειικού ψευδαργύρου (ZnSO4) 1M
3) Διάλυμα χλωριούχου νατρίου (NaCl)
Πειραματική διαδικασία:
1) Τοποθετούμε τα δύο ποτήρια της ηλεκτρόλυσης πολύ κοντά το ένα με το άλλο.
2) Το ένα ποτήρι το γεμίζουμε με 100 ml διαλύματος ZnSO4 1M και το άλλο με 100 ml διαλύματος CuSO4 1M.
3) Διαποτίζουμε την ταινία του διηθητικού χαρτιού με διάλυμα χλωριούχου νατρίου (NaCl).
4) Τοποθετούμε την ταινία πάνω από τα δύο ποτήρια, έτσι ώστε τα δύο άκρα της να είναι βυθισμένα στα δύο αντίστοιχα διαλύματα των ποτηριών για να παίξει το ρόλο της γέφυρας άλατος.
5) Τοποθετούμε στο διάλυμα ZnSO4 1M ένα ηλεκτρόδιο ψευδαργύρου και στο διάλυμα CuSO4 1M ένα ηλεκτρόδιο χαλκού, αφού πρώτα τα έχουμε τρίψει με λεπτό γυαλόχαρτο και λεπτό σύρμα.
6) Χρησιμοποιώντας τα καλώδια με τα κροκοδειλάκια συνδέουμε τα άκρα των δύο ηλεκτροδίων με το μιλλιβολτόμετρο με τέτοιον τρόπο ώστε το (+) του βολτομέτρου να συνδέεται με το ηλεκτρόδιο του χαλκού (κάθοδος) και το (-) του βολτομέτρου με το ηλεκτρόδιο του ψευδαργύρου (άνοδος)
7) Μετά από λίγο παρατηρούμε την τάση του ρεύματος που καταγράφει το μιλλιβολτόμετρο.

Στοιχείο Daniell χωρίς τη γέφυρα άλατος: Τάση 0 V

Στοιχείο Daniell με τη γέφυρα άλατος: Τάση 1,08 V
Η Χημεία του πειράματος:
Αναλυτικά λαμβάνουν χώρα οι εξής αντιδράσεις:
Άνοδος (-) αρνητικό ηλεκτρόδιο γίνεται οξείδωση του Zn,
Zn(s) ![]() Zn2+(aq) + 2e-
Zn2+(aq) + 2e-
Κάθοδος (+) θετικό ηλεκτρόδιο γίνεται αναγωγή του Cu,
Cu2+(aq) + 2e- ![]() Cu(s)
Cu(s)
Συνολική αντίδραση Zn(s) + Cu2+(aq) ![]() Zn2+(aq) + Cu(s)
Zn2+(aq) + Cu(s)
Ε0στοιχείου = Ε0οξειδοαναγωγής καθόδου – Ε0οξειδοαναγωγής ανόδου άρα Ε0στοιχείου = 0,34 - (- 0,76) άρα Ε0στοιχείου = 1,1 V
Tα e- κινούνται από το ηλεκτρόδιο του Zn στο ηλεκτρόδιο του Cu. Οι αντιδράσεις αυτές συνεχίζονται όσο το κύκλωμα είναι κλειστό και τα αντιδρώντα σώματα δεν έχουν εξαντληθεί.
Το στοιχείο αυτό συμβολίζεται ως εξής :
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
άνοδος κάθοδος
Εργαστηριακή αναφορά |
|
Επώνυμο: |
|
Όνομα: |
|
Τμήμα: |
|
Ημερομηνία: |
|
Προεργαστηριακές ερωτήσεις:
1. Να απαντήσετε τι ισχύει σε ένα γαλβανικό στοιχείο:
α) Σε ποιο ηλεκτρόδιο γίνεται οξείδωση και σε ποιο αναγωγή;
β) Ποιο είναι το θετικό και ποιο το αρνητικό ηλεκτρόδιο;
γ) Ποια είναι η ροή των ηλεκτρονίων κατά τη λειτουργία του γαλβανικού στοιχείου;
2. Πώς ορίζεται το Ε0 (κανονικό ή πρότυπο δυναμικό γαλβανικού στοιχείου) (Ορισμός – Τύπος).
3. Δίνεται το γαλβανικό στοιχείο: Zn(s) / Zn2+(aq) // Fe3+(aq) , Fe2+(aq) / Pt
Να γράψετε τη συνολική οξειδοαναγωγική αντίδραση με τη μέθοδο των ημιαντιδράσεων και να υπολογιστεί το Ε0 του γαλβανικού στοιχείου.
Δίνεται: Zn2+(aq) + 2e- ![]() Zn(s) με Ε0= -0,763 V
Zn(s) με Ε0= -0,763 V
Fe3+(aq) + e- ![]() Fe2+(aq) με Ε0 = 0,771
Fe2+(aq) με Ε0 = 0,771
Μεταεργαστηριακές ερωτήσεις:
1. Ποιος είναι ο ρόλος της γέφυρας άλατος κατά τη λειτουργία του γαλβανικού στοιχείου Daniell;
2. Κατά τη λειτουργία του γαλβανικού στοιχείου Daniell παρατηρούμε κάποιες αλλαγές στα ηλεκτρόδια Zn και Cu.
Να καταγράψετε αυτές τις αλλαγές και να τις δικαιολογήσετε.
3. Το Ε0 του γαλβανικού στοιχείου Daniell, παρατηρούμε και από το βολτόμετρο ότι είναι 1,1V. Εάν θέλαμε να κατασκευάσουμε ένα άλλο γαλβανικό στοιχείο με Ε0 μεγαλύτερο του 1,1V, δώστε δύο υποδείξεις για την επιλογή των ηλεκτροδίων που θα χρησιμοποιούσατε και δικαιολογείστε την επιλογή σας. Μπορείτε να χρησιμοποιήσετε τα κανονικά ή πρότυπα δυναμικά οξειδοαναγωγής από τον αντίστοιχο πίνακα του βιβλίου σας.
4. Είναι γνωστό ότι κατά τη λειτουργία του στοιχείου Daniell ο Zn οξειδώνεται και ο Cu ανάγεται. Πώς νομίζετε ότι θα μπορούσαμε να πετύχουμε το αντίθετο δηλαδή ο Zn να ανάγεται και ο Cu να οξειδώνεται; Υποθέστε ότι έχετε στη διάθεσή σας μια πηγή ρεύματος. Εξηγήστε όλες τις κινήσεις που θα κάνατε για να το πετύχετε.
Απαντήσεις στις προεργαστηριακές ερωτήσεις:
1. α) Κατά τη λειτουργία ενός γαλβανικού στοιχείου, οξείδωση πραγματοποιείται στο ηλεκτρόδιο της ανόδου και αναγωγή πραγματοποιείται στο ηλεκτρόδιο της καθόδου όπως ακριβώς συμβαίνει και σε ένα ηλεκτρολυτικό στοιχείο.
β) Θετικό είναι το ηλεκτρόδιο της καθόδου και αρνητικό είναι το ηλεκτρόδιο της ανόδου σε αντίθεση με ένα ηλεκτρολυτικό στοιχείο.
γ) Η ροή των ηλεκτρονίων κατά τη λειτουργία ενός γαλβανικού στοιχείου είναι η εξής: Τα e- παράγονται στην άνοδο από διαδικασία οξείδωσης και κινούνται μέσω του εξωτερικού κυκλώματος των μεταλλικών αγωγών προς την κάθοδο όπου και καταναλώνονται σε διαδικασία αναγωγής.
2) Πρότυπο ή κανονικό δυναμικό στοιχείου (E0στοιχείου) ονομάζεται το δυναμικό του στοιχείου σε πρότυπη κατάσταση. Δηλαδή είναι η διαφορά δυναμικού (τάση) που εμφανίζεται στα άκρα των ηλεκτροδίων του γαλβανικού στοιχείου, όταν αυτό δε διαρέεται από ηλεκτρικό ρεύμα και όλες οι ουσίες που συμμετέχουν στο στοιχείο βρίσκονται σε πρότυπη κατάσταση. Πρότυπη κατάσταση μιας ουσίας (στοιχείου ή ένωσης) είναι η πιο σταθερή μορφή της σε Ρ = 1 atm, Θ = 25 0C ή Τ = 298 Κ, C = 1 Μ.
Για να υπολογίσουμε το Ε0 ενός γαλβανικού στοιχείου εφαρμόζουμε τον τύπο: E0στοιχείου = Ε0οξειδοαναγωγής καθόδου - Ε0οξειδοαναγωγής ανόδου
3. Άνοδος (-) Zn(s) ![]() Zn2+(aq) + 2e-
Zn2+(aq) + 2e-
Οξείδωση
Κάθοδος (+) Fe3+(aq) + e- ![]() Fe2+(aq) Χ2
Fe2+(aq) Χ2
Αναγωγή 2Fe3+(aq) + 2e- ![]() 2Fe2+(aq)
2Fe2+(aq)
Συνολική αντίδραση Zn(s) + 2Fe3+(aq) ![]() Zn2+(aq) + 2Fe2+(aq)
Zn2+(aq) + 2Fe2+(aq)
Ε0στοιχείου = Ε0 οξειδοαναγωγής καθόδου – Ε0 οξειδοαναγωγής ανόδου άρα Ε0στοιχείου = 0,771 - (- 0,763) άρα Ε0στοιχείου = 1,534 V
Απαντήσεις στις μεταεργαστηριακές ερωτήσεις:
1. Η γέφυρα άλατος έχει δύο ρόλους:
α) Κλείνει το κύκλωμα επιτρέποντας την κίνηση του φορτίου από το ένα δοχείο στο άλλο.
β) Εξισορροπεί την αύξηση του θετικού φορτίου στο διάλυμα της ανόδου ενώ ταυτόχρονα εξισορροπεί την αύξηση του αρνητικού φορτίου στο διάλυμα της καθόδου μέσω της κίνησης των ιόντων του διαλύματος του άλατος που περιέχει. Αν δε γινόταν αυτή η εξουδετέρωση της περίσσειας των φορτίων στα δύο διαλύματα, θα σταματούσε η λειτουργία του στοιχείου.
2. Κατά τη λειτουργία του γαλβανικού στοιχείου Daniell παρατηρούμε ότι, όσο περνάει ο χρόνος λειτουργίας, το φύλλο του μεταλλικού Zn διαλύεται ενώ αποτίθεται Cu στο φύλλο του μεταλλικού Cu. Αυτό συμβαίνει γιατί στο ηλεκτρόδιο του Zn, που αποτελεί την άνοδο, πραγματοποιείται αντίδραση οξείδωσης του μεταλλικού Zn σύμφωνα με τη χημική εξίσωση:
Zn(s) → Zn2+(aq) + 2e-
Ενώ στο ηλεκτρόδιο του Cu, που αποτελί την κάθοδο του στοιχείου πραγματοποιείται αντίδραση αναγωγής του μεταλλικού Cu σύμφωνα με τη χημική εξίσωση:
Cu2+(aq) + 2e- → Cu(s)
3. Το Ε0 (κανονικό ή πρότυπο δυναμικό οξειδοαναγωγής) ενός γαλβανικού στοιχείου υπολογίζεται με βάση το τύπο:
Ε0στοιχείου = Ε0οξειδοαναγωγής καθόδου - Ε0οξειδοαναγωγής ανόδου
Όσο πιο μεγάλο είναι το Ε0οξειδοαναγωγής καθόδου ή όσο πιο μικρό είναι το Ε0οξειδοαναγωγής ανόδου τόσο πιο μεγάλο βγαίνει το αποτέλεσμα Ε0στοιχείου.
Άρα θα πρέπει να επιλέξουμε για άνοδο ένα στοιχείο που έχει χαμηλότερο Ε0οξειδοαναγωγής ανόδου απ’ αυτό του Zn, δηλαδή να είναι πιο αναγωγικό από τον Zn και άρα να βρίσκεται πριν από τον Zn στη σειρά δραστικότητας. Ένα τέτοιο στοιχείο μπορεί να είναι το Al ή το Mg.
Αντίστοιχα για κάθοδο μπορούμε ένα επιλέξουμε ένα στοιχείο που έχει υψηλότερο Ε0οξειδοαναγωγής καθόδου απ’ αυτό του Cu, δηλαδή να είναι πιο οξειδωτικό από τον Cu και άρα να βρίσκεται μετά από τον Cu στη σειρά δραστικότητας. Ένα τέτοιο στοιχείο μπορεί να είναι ο Ag ή ο Hg ή ο Au.
Επίσης θα μπορούσαμε να διατηρήσουμε για άνοδο τον Zn και να επιλέξουμε για κάθοδο ένα από τα Ag, Hg ή Au. Αντίστοιχα θα μπορούσαμε να διατηρήσουμε για κάθοδο τον Cu και να επιλέξουμε για άνοδο ένα από τα Al ή Mg.
4. Εάν υποθέσουμε ότι θέλουμε ο Zn να ανάγεται και ο Cu να οξειδώνεται, προφανώς μια τέτοια οξειδοαναγωγική αντίδραση δεν είναι αυθόρμητη μια και δεν μπορεί να πραγματοποιηθεί μόνη της αφού βγαίνει το Ε0στοιχείου αρνητικό σύμφωνα με τον τύπο:
Ε0στοιχείου = Ε0οξειδοαναγωγής καθόδου - Ε0οξειδοαναγωγής ανόδου
Ε0στοιχείου = -0,76 – (+0,34) = -1,1V
Για να πραγματοποιηθεί μια τέτοια αντίδραση πρέπει να χρησιμοποιήσουμε πηγή ρεύματος με τάση μεγαλύτερη από 1,1V, συνδέοντας τον αρνητικό πόλο της πηγής με το ηλεκτρόδιο που θέλουμε να λειτουργήσει ως κάθοδος όπου θα γίνεται αναγωγή, δηλαδή με το ηλεκτρόδιο του Zn.
Αντίστοιχα τον θετικό πόλο της πηγής τον συνδέουμε με το ηλεκτρόδιο που θέλουμε να λειτουργήσει ως άνοδος όπου θα γίνεται οξείδωση, δηλαδή με το ηλεκτρόδιο του Cu.
|