

- ΟΞΕΙΔΟΑΝΑΓΩΓΗ
- Εισαγωγή
- Αριθμός οξείδωσης
- Οξείδωση-Αναγωγή
- Οξειδωτικά-Αναγωγικά
- Ημιαντιδράσεις οξείδωσης-αναγωγής
- Αντιδράσεις οξειδοαναγωγής με τη μέθοδο ημιαντιδράσεων
- ΙΔΙΟΤΗΤΕΣ ΜΕΤΑΛΛΩΝ-ΑΓΩΓΟΙ
- Εισαγωγή
- Δομή μεταλλικού πλέγματος
- Δραστικότητα μετάλλων
- Ηλεκτροδιαλυτική τάση μετάλλων
- Ηλεκτρικοί αγωγοί
- ΓΑΛΒΑΝΙΚΑ ΣΤΟΙΧΕΙΑ
- Εισαγωγή
- Γαλβανικά στοιχεία
- Ημιστοιχεία-Ε ημιστοιχείων
- Ε0 ημιστοιχείων
- Γέφυρα άλατος
- Συμβολισμός ημιστοιχείου-Ηλεκτρόδια ημιστοιχείων
- Συμβολισμός γαλβανικού στοιχείου
- Ε στοιχείου - Ε0 στοιχείου-Υπολογισμοί Ε0
- Γραφή συνολικής αντίδρασης στοιχείου
- Παραδείγματα γραφής στοιχείων
- ΔG οξειδοαναγωγικής αντίδρασης
- Εξίσωση Nerst
- Παραδείγματα χρήσης εξίσωσης Nerst
- Εφαρμογές στοιχείων -Μπαταρίες
- ΠΕΙΡΑΜΑ - Στοιχείο Daniell
- ΗΛΕΚΤΡΟΛΥΣΗ
- Ηλεκτρολυτικά στοιχεία
- Προϊόντα ηλεκτρόλυσης
- Σύγκριση γαλβανικού – ηλεκτρολυτικού στοιχείου
- Παραδείγματα ηλεκτρόλυσης
- Νόμοι Faraday
- ΠΕΙΡΑΜΑ - Ηλεκτρόλυση Η2Ο ή αρ.δ. H2SO4
3.1 Με τι ασχολείται ο κλάδος της ηλεκτροχημείας
Στις οξειδοαναγωγικές αντιδράσεις έχουμε μεταφορά ηλεκτρονίων από το αναγωγικό στο οξειδωτικό σώμα.
Όταν το αναγωγικό και το οξειδωτικό σώμα βρίσκονται σε άμεση επαφή μεταξύ τους και έτσι η μεταφορά ηλεκτρονίων είναι άμεση, τότε έχουμε μια κλασική οξειδοαναγωγική αντίδραση όπως φαίνεται στο παρακάτω σχήμα. Έλασμα ψευδαργύρου (Zn) βυθίζεται μέσα σε ένα υδατικό διάλυμα ιόντων χαλκού (Cu2+). O Zn σαν πιο αναγωγικό σώμα από το Cu, οξειδώνεται οπότε ιόντα ψευδαργύρου (Zn2+) απελευθερώνονται στο διάλυμα και τα ηλεκτρόνια που παράγονται καταναλώνονται στην αναγωγή των ιόντων του χαλκού (Cu2+). Η συνολική οξειδοαναγωγική αντίδραση που συμβαίνει είναι:
Zn + Cu2+ ![]() Zn2+ + Cu
Zn2+ + Cu
ενώ η μεταφορά των ηλεκτρονίων είναι άμεση μια και τα δύο αντιδρώντα βρίσκονται σε επαφή μεταξύ τους.
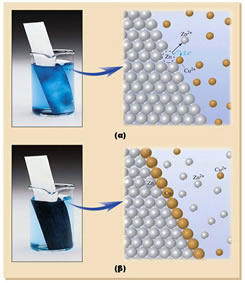
Ο Zn οξειδώνεται και ο Cu ανάγεται. Ιόντα Zn2+απελευθερώνονται στο διάλυμα, ενώ άτομα Cu επικάθονται στην επιφάνεια του μεταλλικού ελάσματος του Zn.
(Εικόνα α)
Μπορούμε επίσης να παρατηρήσουμε την αλλαγή του χρώματος του διαλύματος εξ’ αιτίας αυτού του φαινομένου δηλαδή της ελάττωσης των ιόντων Cu2+ από το διάλυμα, στα οποία οφείλεται το χαρακτηριστικό χρώμα του διαλύματος.
(Εικόνα β)
Όταν όμως το αναγωγικό και το οξειδωτικό σώμα δε βρίσκονται σε άμεση επαφή μεταξύ τους και η μεταφορά ηλεκτρονίων γίνεται μέσω ενός τρίτου σώματος, όπως ένας μεταλλικός αγωγός, τότε μιλάμε για μια ηλεκτροχημική αντίδραση.

Ο κλάδος της ηλεκτροχημείας ασχολείται με τη μελέτη αυτών των αντιδράσεων και περιλαμβάνει δύο μεγάλες ενότητες:
- Γαλβανικά στοιχεία ή Βολταϊκά στοιχεία
- Ηλεκτρολυτικά στοιχεία ή Βολτάμετρα
|