

- ΟΞΕΙΔΟΑΝΑΓΩΓΗ
- Εισαγωγή
- Αριθμός οξείδωσης
- Οξείδωση-Αναγωγή
- Οξειδωτικά-Αναγωγικά
- Ημιαντιδράσεις οξείδωσης-αναγωγής
- Αντιδράσεις οξειδοαναγωγής με τη μέθοδο ημιαντιδράσεων
- ΙΔΙΟΤΗΤΕΣ ΜΕΤΑΛΛΩΝ-ΑΓΩΓΟΙ
- Εισαγωγή
- Δομή μεταλλικού πλέγματος
- Δραστικότητα μετάλλων
- Ηλεκτροδιαλυτική τάση μετάλλων
- Ηλεκτρικοί αγωγοί
- ΓΑΛΒΑΝΙΚΑ ΣΤΟΙΧΕΙΑ
- Εισαγωγή
- Γαλβανικά στοιχεία
- Ημιστοιχεία-Ε ημιστοιχείων
- Ε0 ημιστοιχείων
- Γέφυρα άλατος
- Συμβολισμός ημιστοιχείου-Ηλεκτρόδια ημιστοιχείων
- Συμβολισμός γαλβανικού στοιχείου
- Ε στοιχείου - Ε0 στοιχείου-Υπολογισμοί Ε0
- Γραφή συνολικής αντίδρασης στοιχείου
- Παραδείγματα γραφής στοιχείων
- ΔG οξειδοαναγωγικής αντίδρασης
- Εξίσωση Nerst
- Παραδείγματα χρήσης εξίσωσης Nerst
- Εφαρμογές στοιχείων -Μπαταρίες
- ΠΕΙΡΑΜΑ - Στοιχείο Daniell
- ΗΛΕΚΤΡΟΛΥΣΗ
- Ηλεκτρολυτικά στοιχεία
- Προϊόντα ηλεκτρόλυσης
- Σύγκριση γαλβανικού – ηλεκτρολυτικού στοιχείου
- Παραδείγματα ηλεκτρόλυσης
- Νόμοι Faraday
- ΠΕΙΡΑΜΑ - Ηλεκτρόλυση Η2Ο ή αρ.δ. H2SO4
3.8 Δυναμικό γαλβανικού στοιχείου (Ε) – Κανονικό ή πρότυπο δυναμικό γαλβανικού στοιχείου (Ε0) - Υπολογισμοί
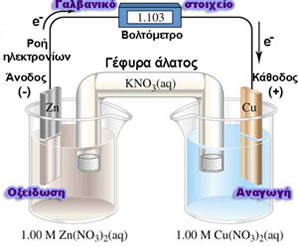
Δυναμικό γαλβανικού στοιχείου (Ε) ονομάζεται η διαφορά δυναμικού (τάση) που εμφανίζεται στα άκρα των ηλεκτροδίων του γαλβανικού στοιχείου, όταν αυτό δε διαρρέεται από ηλεκτρικό ρεύμα.
Πρότυπο ή κανονικό δυναμικό στοιχείου (E0στοιχείου) ονομάζεται το δυναμικό του στοιχείου σε πρότυπη κατάσταση. Δηλαδή είναι η διαφορά δυναμικού (τάση) που εμφανίζεται στα άκρα των ηλεκτροδίων του γαλβανικού στοιχείου, όταν αυτό δε διαρέεται από ηλεκτρικό ρεύμα και όλες οι ουσίες που συμμετέχουν στο στοιχείο βρίσκονται σε πρότυπη κατάσταση.
Πρότυπη κατάσταση μιας ουσίας (στοιχείου ή ένωσης) είναι η πιο σταθερή μορφή της σε Ρ = 1 atm, Θ = 25 0C ή Τ = 298 Κ, C = 1 Μ.
1) Όλα τα Ε0ημιστοιχείων που χρησιμοποιούμε είναι πρότυπα δυναμικά οξειδοαναγωγής (αναφέρονται σε αντιδράσεις αναγωγής).
2) Για να υπολογίσουμε το Ε0 ενός γαλβανικού στοιχείου εφαρμόζουμε τον τύπο: E0στοιχείου = Ε0οξειδοαναγωγής καθόδου - Ε0οξειδοαναγωγής ανόδου
Όπου:
Ε0οξειδοαναγωγής καθόδου = το πρότυπο δυναμικό (πρότυπο δυναμικό οξειδοαναγωγής) του στοιχείου που ανάγεται (κάθοδος).
Ε0οξειδοαναγωγής ανόδου = το πρότυπο δυναμικό (πρότυπο δυναμικό οξειδοαναγωγής) του στοιχείου που οξειδώνεται (άνοδος).
3) Εάν το E0στοιχείου > 0 τότε :
-
Η αντίδραση πραγματοποιείται αυθόρμητα (χωρίς παροχή ηλεκτρικού ρεύματος) προς τη κατεύθυνση που είναι γραμμένη.
-
Το δεξί ηλεκτρόδιο [κάθοδος (+)] έχει θετικότερο δυναμικό από το αριστερό ηλεκτρόδιο [άνοδος (-)].
-
Στο δεξί ηλεκτρόδιο [κάθοδος (+)] γίνεται αναγωγή και στο αριστερό ηλεκτρόδιο [άνοδος (-)] γίνεται οξείδωση.
-
Η ροή των ηλεκτρονίων e- στο εξωτερικό κύκλωμα γίνεται από τα αριστερά προς τα δεξιά, δηλαδή από την άνοδο προς την κάθοδο, δηλαδή από το χαμηλότερο δυναμικό προς το υψηλότερο δυναμικό.

Γαλβανικό στοιχείο: Cu(s) / Cu2+ (aq) // Ag+(aq) / Ag(s)
4) Εάν το E0στοιχείου < 0 τότε :
-
Η αντίδραση όπως είναι γραμμένη δεν μπορεί να πραγματοποιηθεί αυθόρμητα από μόνη της. Αυθόρμητη είναι η αντίστροφή της.
-
Για να πραγματοποιηθεί, όπως είναι γραμμένη, χρειάζεται να επιδράσει εξωτερική πηγή ηλεκτρισμού π.χ. μια μπαταρία, με προσφορά τάσης μεγαλύτερη από την απόλυτη τιμή του Ε0στοιχείου (ηλεκτρόλυση). Η σύνδεση της μπαταρίας πρέπει να γίνει με τέτοιο τρόπο ώστε ο αρνητικός πόλος της να συνδεθεί με το ηλεκτρόδιο που θέλουμε να λειτουργεί ως κάθοδος. Αυτό σημαίνει ότι το σώμα που πριν οξειδωνόταν στην άνοδο, τώρα θα ανάγεται στην κάθοδο. Επίσης το σώμα που πριν αναγόταν στην κάθοδο, τώρα θα οξειδώνεται στην άνοδο.
5) Όταν μια οξειδοαναγωγική αντίδραση έχει Ε0στοιχείου > 0, πράγμα που σημαίνει πως η αντίδραση μπορεί να πραγματοποιηθεί αυθόρμητα όπως είναι γραμμένη, και θέλουμε εμείς να την αντιστρέψουμε, τότε θα πρέπει να εφαρμόσουμε τάση μεγαλύτερη από το Ε0στοιχείου.

Σύγκριση γαλβανικού ηλεκτρολυτικού στοιχείου
6) Η τιμή του Ε0στοιχείου αναφέρεται στην πιθανότητα που έχει μια αντίδραση να πραγματοποιηθεί και όχι στην ποσότητα των σωμάτων τα οποία αντιδρούν. Αυτό σημαίνει ότι το Ε0στοιχείου είναι ανεξάρτητο από τον αριθμό των ηλεκτρονίων e- που μεταφέρονται. Επίσης η τιμή του Ε0στοιχείου δεν μας δίνει πληροφορίες για την ταχύτητα της οξειδοαναγωγικής αντίδρασης.
7) Το Ε0στοιχείου αναφέρεται μόνο σε πρότυπες συνθήκες Ρ = 1 atm, Θ = 25 0C ή Τ = 298 Κ, C = 1 Μ. Μεταβολές στην τιμή πίεσης ή θερμοκρασίας ή συγκέντρωσης επηρεάζουν το Ε0στοιχείου με αποτέλεσμα η τιμή του να αλλάζει.
8) Σε κατάσταση ισορροπίας του συστήματος το δυναμικό του γαλβανικού στοιχείου είναι μηδέν Εστοιχείου = 0.
|