

- ΟΞΕΙΔΟΑΝΑΓΩΓΗ
- Εισαγωγή
- Αριθμός οξείδωσης
- Οξείδωση-Αναγωγή
- Οξειδωτικά-Αναγωγικά
- Ημιαντιδράσεις οξείδωσης-αναγωγής
- Αντιδράσεις οξειδοαναγωγής με τη μέθοδο ημιαντιδράσεων
- ΙΔΙΟΤΗΤΕΣ ΜΕΤΑΛΛΩΝ-ΑΓΩΓΟΙ
- Εισαγωγή
- Δομή μεταλλικού πλέγματος
- Δραστικότητα μετάλλων
- Ηλεκτροδιαλυτική τάση μετάλλων
- Ηλεκτρικοί αγωγοί
- ΓΑΛΒΑΝΙΚΑ ΣΤΟΙΧΕΙΑ
- Εισαγωγή
- Γαλβανικά στοιχεία
- Ημιστοιχεία-Ε ημιστοιχείων
- Ε0 ημιστοιχείων
- Γέφυρα άλατος
- Συμβολισμός ημιστοιχείου-Ηλεκτρόδια ημιστοιχείων
- Συμβολισμός γαλβανικού στοιχείου
- Ε στοιχείου - Ε0 στοιχείου-Υπολογισμοί Ε0
- Γραφή συνολικής αντίδρασης στοιχείου
- Παραδείγματα γραφής στοιχείων
- ΔG οξειδοαναγωγικής αντίδρασης
- Εξίσωση Nerst
- Παραδείγματα χρήσης εξίσωσης Nerst
- Εφαρμογές στοιχείων -Μπαταρίες
- ΠΕΙΡΑΜΑ - Στοιχείο Daniell
- ΗΛΕΚΤΡΟΛΥΣΗ
- Ηλεκτρολυτικά στοιχεία
- Προϊόντα ηλεκτρόλυσης
- Σύγκριση γαλβανικού – ηλεκτρολυτικού στοιχείου
- Παραδείγματα ηλεκτρόλυσης
- Νόμοι Faraday
- ΠΕΙΡΑΜΑ - Ηλεκτρόλυση Η2Ο ή αρ.δ. H2SO4
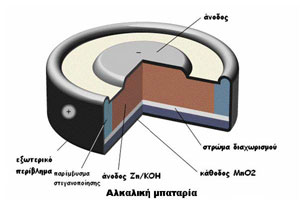
1.δ Αλκαλικές μπαταρίες
Οι αλκαλικές μπαταρίες είναι παρόμοιες με αυτές του Leclanche, με τη διαφορά ότι αντί για τον όξινο ηλεκτρολύτη NH4Cl χρησιμοποιείται ο αλκαλικός ΚΟΗ. Κατ’ αυτόν τον τρόπο η μπαταρία αποκτά καλύτερη απόδοση ακόμα και σε ξηρές ή υγρές συνθήκες.
Το στοιχείο αυτό (αλκαλίου-Mn) έχει σημαντικά υψηλότερη πυκνότητα ενέργειας και διάρκεια ζωής. Έχει άνοδο από αμάλγαμα Zn και κάθοδο από πυρολουσίτη. Ηλεκτρολύτης είναι ένα διάλυμα KOH . Η ονομασία του στοιχείου οφείλεται στον ηλεκτρολύτη από αλκάλιο και στο ηλεκτρόδιο από MnO2. Το πορώδες υλικό από αμάλγαμα Zn βρίσκεται στο εσωτερικό γύρω από ένα χαλύβδινο καρφί και χρησιμεύει ως αγωγός. Κυκλικά γύρω απ’ αυτό διατάσσεται το επίσης πορώδες MnO2. Το αμάλγαμα ψευδαργύρου και το MnO2 είναι διαποτισμένα με τον ηλεκτρολύτη.
Οι χημικές αντιδράσεις είναι παρόμοιες μ’ αυτές στο στοιχείο Leclanche :
Ο Zn εισέρχεται στο διάλυμα Zn(s) → Zn2+(aq) + 2e-
Το χαλύβδινο καρφί άγει τα ηλεκτρόνια στον αρνητικό πόλο.
Στο ηλεκτρόδιο από MnO2 ανάγονται τα ιόντα H3O+ :
2Η3Ο+ + 2e- → 2H + 2H2O
Το ατομικό υδρογόνο δεσμεύεται από τον πυρολουσίτη.
Η τάση στους ακροδέκτες του στοιχείου αλκάλιου/Zn είναι 1,5 V. Εξωτερικά είναι όπως ακριβώς το στοιχείου Zn/C.
|